
【题目】下列实验中现象及得出的结论正确的是( )
实验 | 现象 | 结论 | |
A |
| 试管(1)中紫色褪去,试管(2)中紫色未褪 | 苯环使甲基的活性增强 |
B |
| 试管内壁有银镜生成 | 有机物X中一定是醛 |
C | 向淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜悬浊液并加热 | 未见砖红色沉淀 | 淀粉未水解 |
D |
| 最后一只试管中有浅黄色沉淀 | 有机物中含有溴原子 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种优良的水处理剂。25℃,其水溶液中加酸或碱改变溶液的pH时,含铁粒子的物质的量分数δ(X)随pH的变化如图所示[已知δ(X)=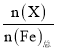 ]。下列说法正确的是( )
]。下列说法正确的是( )

A.K2FeO4、H2FeO4都属于强电解质
B.25℃,H2FeO4+H+![]() H3FeO4+的平衡常数K>100
H3FeO4+的平衡常数K>100
C.由B点数据可知,H2FeO4的第一步电离常数Ka1=4.15×10-4
D.A、C两点对应溶液中水的电离程度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扁桃酸衍生物是重要的医药中间体,以物质a为原料合成扁桃酸衍生物b的过程如下:下列说法正确的是( )

A.物质X是Br2, 物质a转化为b属于取代反应
B.lmol物质a能与3molH2反应,且能在浓硫酸中发生消去反应
C.物质b具有多种能与NaHCO3反应的同分异构体
D.物质b的核磁共振氢谱有四组峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO、NO2是汽车尾气中主要的含氮氧化物。回答下列问题:
(1)已知氮氧化物转化过程中的能量变化如图(图中表示生成2molNO2的能量变化)。1molNO氧化为NO2的焓变ΔH=___。

(2)某温度下,反应的平衡常数如下:
a.2NO2(g)N2(g)+2O2(g) K=6.7×1016
b.2NO(g)N2(g)+O2(g) K=2.2×1030
分解反应趋势较大的反应是___(填“a”或“b”);反应2NO(g)+O2(g)2NO2(g)的K=___(保留三位有效数字)。
(3)已知反应2NO(g)+O2(g)2NO2的正反应速率v正=k1cm(NO)cn(O2),其中k为速率常数,可通过下列实验数据计算k、m、n。
起始浓度/molL-1 | |||
组别 | NO | O2 | 初始速率 /molL-1s-1 |
1 | 0.02 | 0.0125 | 7.98×10-3 |
2 | 0.02 | 0.0250 | 15.96×10-3 |
3 | 0.04 | 0 0125 | 31.92×10-3 |
则k1=___,m=___,n=___。
(4)已知该反应的历程为:
第一步:NO+NO![]() N2O2 快速平衡
N2O2 快速平衡
第二步:N2O2+O2![]() 2NO2 慢反应
2NO2 慢反应
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v(正)=k1c2(NO),v(逆)=k-1c(N2O2)。下列叙述正确的是___(填字母)。
A.第一步反应的平衡常数K=![]()
B.v(第一步的正反应)<v(第一步的反应)
C.第二步的活化能比第一步的活化能高
D.第二步中N2O2与O2的碰撞100%有效
(5)一定条件下测得容器中NO、O2、NO2浓度发生如图变化。

①NO的平衡转化率为___。
②该温度下反应2NO(g)+O2(g)2NO2(g)的平衡常数为___(保留整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1和图2是A、B两种物质的核磁共振氢谱。请根据图1和图2两种物质的核磁共振氢谱谱图选择出可能属于图1和图2的两种物质的分子式( )
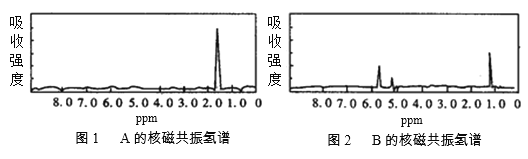
A.A是C3H6、B是C2H6
B.A是C6H6、B是C4H6
C.A是C6H6、B是C2H6
D.A是C3H8、B是C6H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际气候变化经济学报告中显示,大气中CO2浓度每增加一倍,可使地表平均温度上升56℃。为减少温室效应的加剧,需将工业生产中产生的CO2分离出来加以利用。回答下列问题:
(1)在500℃时,Li4SiO4与低浓度的CO2反应生成两种锂盐,待该反应达到化学反应的限度后,升温至700℃,两种锂盐反应放出高浓度的CO2,而Li4SiO4可循环利用。写出700℃时两种锂盐反应的化学方程式___。
(2)CO2与NH3反应可合成化肥。
①已知:2NH3(g)+CO2(g)=NH2COONH4(s) △H=-159.5kJmol-1
NH2COONH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5kJmol-1
H2O(l)=H2O(g) △H=+44.0kJmo1-1
则CO2(g)+2NH3(g)=CO(NH2)2(s)+H2O(l)的△H=___kJmol-1
②将足量CO2通入饱和氨水中可制得碳铵(NH4HCO3)。已知室温下Kb(NH3H2O)=1.8×10-5,Ka1(H2CO3)=4.3×10-7,则0.0.1molL-1NH4HCO3溶液室温下呈___ (填“酸性”、“中性”或“碱性”)。
(3)在一定条件下,CO2与H2可用于合成甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。在体积可变的恒压密闭容器中,该反应在不同温度、不同投料比[![]() ]达平衡时CO2的转化率[α(CO2)]如图1所示。
]达平衡时CO2的转化率[α(CO2)]如图1所示。
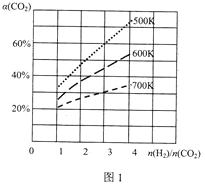
该反应的△H___0(填“>”、“=”或“<”)。
②500K、投料比[![]() ]=3时,H2的平衡转化率为___;设总压强为P0,则化学平衡常数Kp=___(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
]=3时,H2的平衡转化率为___;设总压强为P0,则化学平衡常数Kp=___(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③直接甲醇燃料电池(DMFC)具备低温快速启动、燃料洁净环保以及电池结构简单等特性。该电池使用合适的合金为电极,以氢氧化钠溶液、甲醇、空气为原料。写出其负极电极反应式___。
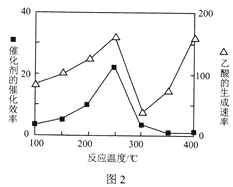
(4)在TiO2/Cu2Al2O4为催化剂时,CO2和CH4可反应生成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图2所示。300℃400℃时,影响乙酸生成速率的主要因素是___(填“温度”或“催化剂”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能证明甲酸(HCOOH,一元酸)为弱酸的是( )
A.0.1mol/L甲酸的pH为2.3
B.将pH=2的甲酸稀释100倍后,溶液的pH小于4
C.温度升高,溶液的导电能力增强
D.等体积等浓度的甲酸和HCl与足量的锌反应,产生等量的氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是网络表情包“苯宝宝装纯(醇)”,该分子由“苯宝宝”与羟基相连,下列说法正确的是
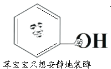
A.该分子属于醇B.该分子中含有两种含氧官能团
C.该物质在空气中放置一段时间会变为粉红色D.该分子苯环上的一个氢原子被丙基(-C3H7)取代所得的同分异构体最多有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的( )
A.常温下,将 1mL pH=3 的醋酸溶液加水稀释到 100mL,测得其 PH<5
B.红棕色的 NO2,加压后颜色先变深后变浅
C.工业合成氨中通常采取高温及加入催化剂,提高生产效益
D.实验室制取氨气利用浓氨水和固体氢氧化钠混合的方法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com