
����Ŀ����������仯����ѧ��������ʾ��������CO2Ũ��ÿ����һ������ʹ�ر�ƽ���¶�����56�档Ϊ��������ЧӦ�ļӾ磬�轫��ҵ�����в�����CO2��������������á��ش��������⣺
��1����500��ʱ��Li4SiO4���Ũ�ȵ�CO2��Ӧ����������Σ����÷�Ӧ�ﵽ��ѧ��Ӧ���Ⱥ�������700�棬������η�Ӧ�ų���Ũ�ȵ�CO2����Li4SiO4��ѭ�����á�д��700��ʱ������η�Ӧ�Ļ�ѧ����ʽ___��
��2��CO2��NH3��Ӧ�ɺϳɻ��ʡ�
����֪��2NH3(g)+CO2(g)=NH2COONH4(s) ��H=-159.5kJmol-1
NH2COONH4(s)=CO(NH2)2(s)+H2O(g) ��H=+116.5kJmol-1
H2O(l)=H2O(g) ��H=+44.0kJmo1-1
��CO2(g)+2NH3(g)=CO(NH2)2(s)+H2O(l)����H=___kJmol-1
�ڽ�����CO2ͨ�뱥�Ͱ�ˮ�п��Ƶ�̼�(NH4HCO3)����֪������Kb(NH3H2O)=1.8��10-5��Ka1(H2CO3)=4.3��10-7����0.0.1molL-1NH4HCO3��Һ�����³�___ (������������������������������)��
��3����һ�������£�CO2��H2�����ںϳɼ״���CO2(g)+3H2(g)CH3OH(g)+H2O(g)��������ɱ�ĺ�ѹ�ܱ������У��÷�Ӧ�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�[![]() ]��ƽ��ʱCO2��ת����[��(CO2)]��ͼ1��ʾ��
]��ƽ��ʱCO2��ת����[��(CO2)]��ͼ1��ʾ��
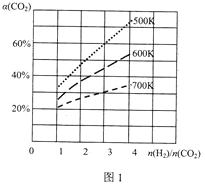
�÷�Ӧ����H___0(����>������=������<��)��
��500K��Ͷ�ϱ�[![]() ]=3ʱ��H2��ƽ��ת����Ϊ___������ѹǿΪP0����ѧƽ�ⳣ��Kp=___(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������)��
]=3ʱ��H2��ƽ��ת����Ϊ___������ѹǿΪP0����ѧƽ�ⳣ��Kp=___(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������)��
��ֱ�Ӽ״�ȼ�ϵ��(DMFC)�߱����¿���������ȼ�Ͻྻ�����Լ���ؽṹ�����ԡ��õ��ʹ�ú��ʵĺϽ�Ϊ�缫��������������Һ���״�������Ϊԭ�ϡ�д���为���缫��Ӧʽ___��
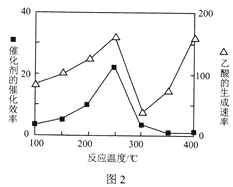
��4����TiO2/Cu2Al2O4Ϊ����ʱ��CO2��CH4�ɷ�Ӧ�������ᡣ�ڲ�ͬ�¶��´����Ĵ�Ч����������������ʵĹ�ϵ��ͼ2��ʾ��300��400��ʱ��Ӱ�������������ʵ���Ҫ������___(�����¶�������������)��
���𰸡�Li2CO3+Li2SiO3![]() Li4SiO4+CO2�� -87.0 ���� < 60%
Li4SiO4+CO2�� -87.0 ���� < 60% ![]() ��
��![]() CH3OH-6e-+8OH-=CO32-+6H2O �¶�
CH3OH-6e-+8OH-=CO32-+6H2O �¶�
��������
��1����500��ʱ��Li4SiO4���Ũ�ȵ�CO2��Ӧ����������Σ������ó���̼��﮺���ﮣ����������ٷ�Ӧ���ɶ�����̼���ݴ�д������ʽ��
��2�����ɢ�2NH3��g��+CO2��g��=NH2CO2NH4��s����H=-159.5kJmol-1
��NH2CO2NH4��s��=CO��NH2��2��s��+H2O��g����H=+116.5kJmol-1
��H2O��l��=H2O��g����H=+44.0kJmol-1
��ϸ�˹���ɿ�֪����+��-�۵õ�2NH3��g��+CO2��g��=CO��NH2��2��s��+H2O��l�����Դ������
�ڸ���Kb(NH3H2O)=1.8��10-5>Ka1(H2CO3)=4.3��10-7��˭ǿ��˭�Է�����
��3���ٴ�ͼ�п��Կ��������¶ȶ�����̼��ת���ʽ��ͣ�˵�������¶�ƽ��������У����Է���������Ӧ�Ƿ��ȷ�Ӧ��
��500K��Ͷ�ϱ�[![]() ]=3ʱ����ͼ���п��Կ����������¶�����̼��ת������60%��Ͷ�ϱȵ��ڻ�ѧ������֮�ȣ���Ӧ���ת������ȣ�
]=3ʱ����ͼ���п��Կ����������¶�����̼��ת������60%��Ͷ�ϱȵ��ڻ�ѧ������֮�ȣ���Ӧ���ת������ȣ�
�۸��ݼ״��������ڼ�����Һ�з�Ӧ���ܷ�Ӧд��������Ӧʽ��
(4)��ͼ2֪��![]() ʱ�������Ĵ�Ч�ʷdz��ͣ��¶����߷�Ӧ�����������Ӱ�������������ʵ���Ҫ�������¶ȡ�
ʱ�������Ĵ�Ч�ʷdz��ͣ��¶����߷�Ӧ�����������Ӱ�������������ʵ���Ҫ�������¶ȡ�
![]() ��
��![]() ��
��![]() ��
��![]() �Ӵ�������
�Ӵ�������![]() ����Ӧ��Ϊ
����Ӧ��Ϊ![]() ��
��![]() ����������
����������![]() �����������غ��֪���ﻹ��
�����������غ��֪���ﻹ��![]() ������
������![]() ʱ��Ӧ�Ļ�ѧ����ʽΪ��
ʱ��Ӧ�Ļ�ѧ����ʽΪ��![]()
![]()
![]() ��
��
�ʴ�Ϊ��![]()
![]()
![]() ��
��
![]()
![]()
![]()
![]() �ã�
�ã�![]() ��
��
�ʴ�Ϊ��![]() ��
��
![]() ˮ��ƽ�ⳣ��
ˮ��ƽ�ⳣ��![]() ˮ��ƽ�ⳣ��
ˮ��ƽ�ⳣ��![]() ��
��![]() ˮ�����Һ�����ԡ�
ˮ�����Һ�����ԡ�![]() ˮ�����Һ�ʼ��ԣ�
ˮ�����Һ�ʼ��ԣ�
�ʴ�Ϊ�����ԣ�
![]() ��ͼ1����Ͷ�ϱ�
��ͼ1����Ͷ�ϱ�![]() ��ͬʱ���¶�Խ�ߣ�������̼��ת����ԽС��������Ӧ���ȣ�
��ͬʱ���¶�Խ�ߣ�������̼��ת����ԽС��������Ӧ���ȣ�![]() ��
��
�ʴ�Ϊ��![]() ��
��
![]() ��ͼ1֪��500K��Ͷ�ϱ�
��ͼ1֪��500K��Ͷ�ϱ�![]() ʱ��
ʱ��![]() ��ƽ��ת����Ϊ
��ƽ��ת����Ϊ![]() ������ʼʱ
������ʼʱ![]() ����
����![]() ��
��
![]()
��ʼ���ʵ���![]() 1 3 0 0
1 3 0 0
��Ӧ���ʵ���![]()
![]()
![]()
![]()
![]()
ƽ�����ʵ���![]()
![]()
![]()
![]()
![]()
��![]() ��ת����
��ת����![]() ��
��
ƽ��������ʵ���![]() ��
��
 ��
��
�ʴ�Ϊ��![]() ��
��![]() ��
��![]() ��
��
![]() ������������Һ���״�������Ϊԭ�ϣ������缫��Ӧʽ
������������Һ���״�������Ϊԭ�ϣ������缫��Ӧʽ![]() ��
��
�ʴ�Ϊ��![]() ��
��
![]() ��ͼ2֪��
��ͼ2֪��![]() ʱ�������Ĵ�Ч�ʷdz��ͣ��¶����߷�Ӧ�����������Ӱ�������������ʵ���Ҫ�������¶ȣ�
ʱ�������Ĵ�Ч�ʷdz��ͣ��¶����߷�Ӧ�����������Ӱ�������������ʵ���Ҫ�������¶ȣ�
�ʴ�Ϊ���¶ȡ�


 ˫��ͬ������ѵ��ϵ�д�
˫��ͬ������ѵ��ϵ�д� �Ƹ�С״Ԫͬ������������ϵ�д�
�Ƹ�С״Ԫͬ������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ᡢ��ζ����ڵ���ʣ��ǹ�ҵ�����������������Ҫԭ�ϣ��밴Ҫ��ش��������⣺
(1)��������ϡ��Һ���ֱ��ǣ�A.������Һ B.������Һ C. NaOH��Һ D.��ˮ
ȡ����������Һ�����кͷ�Ӧ����ѡ����ʵĶ��������Ŀ�Ľ��
��A��C��ϡ��Һ�����кͷ�Ӧ����1molˮʱ���ų�57.3kJ����������д�����кͷ�Ӧ���Ȼ�ѧ����ʽ______________________________.
������к͵ζ�ʱ����ѡ����ʵ�ָʾ�������������Ͻ��еζ�ʱ������ѡ�����Ϊָʾ����____(ѡ����ĸ)
a.A��C b.A��D c. B�� C d. B��D
��B�м������;֮һ������������������Һ��(HCOOH~HCOONa)����д��������뷽��ʽ___________________________����֪һ���¶��£�����ĵ���ƽ�ⳣ�� Ka=1.8��10��4������ 0.2mol��L��1HCOOH ��Һ100mL����pHΪ4�Ļ�����Һ�������_______mL(�𰸱���һλС��) 0.2mol�� L��1NaOH��Һ��
(2)��(As)��һЩ�����Ϳ�ɽ��ˮ�е���ȾԪ�أ�H3AsO3(������)��H3AsO4(������)ˮ��Һ�к���ĸ����ֵķֲ�����(ƽ��ʱij���ֵ�Ũ��ռ������Ũ���ܺ͵ı�ֵ)��pH��ϵ�ֱ���ͼ����
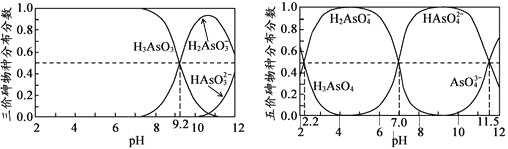
���Է�̪Ϊָʾ������NaOH��Һ��μ��뵽H3AsO3��Һ��,����Һ����ɫ��Ϊdz��ɫʱֹͣ�μӣ���ʱ��Ԫ�ص���Ҫ������ʽΪ________________(�����Ļ�ѧʽ)����֪ pKa1 = ��lgKa1
H3AsO4��һ�����뷽��ʽΪH3AsO4![]() H2AsO4- + H+ ���볣��ΪKa1,��pKa1=______��
H2AsO4- + H+ ���볣��ΪKa1,��pKa1=______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̼���ó�Ϊ����һ���µ��������������̼�IJ���������һ����Ҫ�о����� �ȿɱ��Ϊ�����ֿɼ���̼���ŷš���ҵ�Ͽ���CO2��H2�Ʊ�����Ϊ��21���͵����ȼ����������(CH3OCH3)��
����500��ʱ�����ܱ������н������е�CO2ת��Ϊ�����ѣ�����ط�ӦΪ��
����ӦI��2CO2 (g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ��H1
CH3OCH3(g)+3H2O(g) ��H1
����ӦII��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H2
CH3OH(g)+H2O(g) ��H2
(1)��֪����CO(g)+2H2(g)![]() CH3OH(g) ��H=-90.1kJ/mol
CH3OH(g) ��H=-90.1kJ/mol
��2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ��H=-24.5kJ/mol
CH3OCH3(g)+H2O(g) ��H=-24.5kJ/mol
��CO(g)+H2O(g)![]() CO2(g)+H2(g) ��H= -41.0kJ/mol
CO2(g)+H2(g) ��H= -41.0kJ/mol
������ӦI����H1=______��
(2)��һ���¶���ij�ܱ������а�CO2��H2��Ũ�ȱ�Ϊ1��3Ͷ�Ͻ��з�Ӧ����ò�ͬʱ��β������ʵ�Ũ�����±���

��10-20min �ڣ�CH3OCH3��ƽ����Ӧ����v(CH3OCH3)=_______��
�ڸ����������ݼ�������ӦI��ƽ�ⳣ��K=______(��ʽ���������ݣ���������)��
(3)�����CH3OCH3���ʵĹؼ���������ѡ�ú��ʵĴ�������ԭ����_______��
(4)���ڷ�ӦII���¶ȶ�CO2��ת���ʼ�������Ч��Ӱ����ͼ��ʾ�������й�˵������ȷ����_______��

A.�����������䣬����ʹ�ô�������250��ʱCO2��ƽ��ת���ʿ���λ��Ml
B.�¶ȵ���250��Cʱ�����¶����״��IJ�������
C.M��ʱƽ�ⳣ����N��ʱƽ�ⳣ����
D.ʵ�ʷ�ӦӦ�������ڽϵ͵��¶��½��У������CO2��ת��
(5)����̫���ܵ�ؽ�CO2ת��Ϊ��ϩ����ϩ���л�����ԭ�ϣ��乤��ԭ����ͼ��ʾ����aΪ̫���ܵ�ص�_______����дM�������ɱ�ϩ�ĵ缫��ӦʽΪ_________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ϊ5 mL�ļס��ҡ�������Һ���������Թܱڻ��������Թ���(����)��������ͼ��ʾ��ʵ��������ס��ҡ�������Ͽ�����(����)
![]()
ѡ�� | A | B | C | D |
�� | 1,2�������� | �屽 | ˮ | �Ҵ� |
�� | ˮ | Һ�� | ���� | ���� |
�� | �� | �Ҵ� | ��ˮ | �������� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������ó��Ľ�����ȷ���ǣ� ��
ʵ�� | ���� | ���� | |
A |
| �Թܣ�1������ɫ��ȥ���Թܣ�2������ɫδ�� | ����ʹ���Ļ�����ǿ |
B |
| �Թ��ڱ����������� | �л���X��һ����ȩ |
C | �������Һ�м���ϡ���ᣬˮԡ���ȣ�һ��ʱ����ټ������Ƶ�������ͭ����Һ������ | δ��ש��ɫ���� | ����δˮ�� |
D |
| ���һֻ�Թ�����dz��ɫ���� | �л����к�����ԭ�� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ����Ҫ�Ļ���ԭ�ϣ��Ա�ϩΪԭ�Ϻϳ��л���������ī����DAP-A��֬���������£�

�ش����⣺
��1��д���������ʿ��ܵĽṹ��ʽ��B___________________��F________________________��
��2��д����Ӧ���ͣ���Ӧ��___________________����Ӧ��____________________________��
��3��1 mol DAP-A��֬��һ����������H2�����ӳɷ�Ӧ���������H2_______________mol��
��4��д����Ӧ���Ļ�ѧ����ʽ_____________________________________________________��
��5��д��G��һ�����������Ҷ���������Ӧ����һ�ָ߷��ӻ�����Ļ�ѧ����ʽΪ_______��
��6��E��ͬ���칹���У������������״�л�����HCOOCH2CH=CH2��HCOOCH=CHCH3��___________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������10mL0.1mol/LNaOH��Һ�м���0.1mol/L��һԪ��HA��Һ����ҺpH�ı仯������ͼ������˵������ȷ����
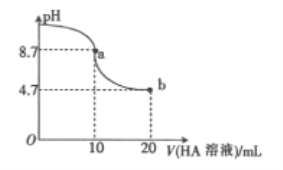
A. a����ʾ��Һ��:c(A-)>c(Na+)>c(OH-)>c(H+)
B. a����ʾ��Һ��:c(Na+)=0.05mol/L
C. pH=7ʱ��c(Na+)=c(A-)
D. b����ʾ��Һ��:c(Na+)<c(A-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾװ�ý�������ʵ�飬���в���������

A.��CCl4��ȡ��ˮ�еĵ�B.��NaOH��Һ��ȥ�屽�е���
C.��ˮ��ȥӲ֬�����еĸ���D.�ñ���Na2CO3��Һ��ȥ���������е�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��38.4 mgͭ��������Ũ���ᷴӦ��ͭȫ�����ú��ռ���22.4 mL(��״����)���壬��Ӧ���ĵ�HNO3�����ʵ��������� (����)
A.1.0��10��3 molB.1.6��10��3 molC.2.2��10��3 molD.2.4��10��3 mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com