
����Ŀ���ᡢ��ζ����ڵ���ʣ��ǹ�ҵ�����������������Ҫԭ�ϣ��밴Ҫ��ش��������⣺
(1)��������ϡ��Һ���ֱ��ǣ�A.������Һ B.������Һ C. NaOH��Һ D.��ˮ
ȡ����������Һ�����кͷ�Ӧ����ѡ����ʵĶ��������Ŀ�Ľ��
��A��C��ϡ��Һ�����кͷ�Ӧ����1molˮʱ���ų�57.3kJ����������д�����кͷ�Ӧ���Ȼ�ѧ����ʽ______________________________.
������к͵ζ�ʱ����ѡ����ʵ�ָʾ�������������Ͻ��еζ�ʱ������ѡ�����Ϊָʾ����____(ѡ����ĸ)
a.A��C b.A��D c. B�� C d. B��D
��B�м������;֮һ������������������Һ��(HCOOH~HCOONa)����д��������뷽��ʽ___________________________����֪һ���¶��£�����ĵ���ƽ�ⳣ�� Ka=1.8��10��4������ 0.2mol��L��1HCOOH ��Һ100mL����pHΪ4�Ļ�����Һ�������_______mL(�𰸱���һλС��) 0.2mol�� L��1NaOH��Һ��
(2)��(As)��һЩ�����Ϳ�ɽ��ˮ�е���ȾԪ�أ�H3AsO3(������)��H3AsO4(������)ˮ��Һ�к���ĸ����ֵķֲ�����(ƽ��ʱij���ֵ�Ũ��ռ������Ũ���ܺ͵ı�ֵ)��pH��ϵ�ֱ���ͼ����
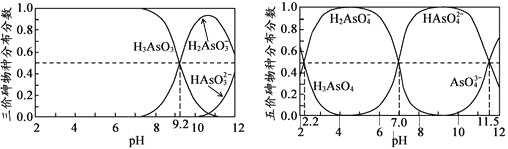
���Է�̪Ϊָʾ������NaOH��Һ��μ��뵽H3AsO3��Һ��,����Һ����ɫ��Ϊdz��ɫʱֹͣ�μӣ���ʱ��Ԫ�ص���Ҫ������ʽΪ________________(�����Ļ�ѧʽ)����֪ pKa1 = ��lgKa1
H3AsO4��һ�����뷽��ʽΪH3AsO4![]() H2AsO4- + H+ ���볣��ΪKa1,��pKa1=______��
H2AsO4- + H+ ���볣��ΪKa1,��pKa1=______��
���𰸡�![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l) ��H=-57.3kJ/mol c HCOOH
Na2SO4(aq)+H2O(l) ��H=-57.3kJ/mol c HCOOH![]() HCOO-+ H+ 64.3 H2AsO3-��H3AsO3 2.2
HCOO-+ H+ 64.3 H2AsO3-��H3AsO3 2.2
��������
��1����ǿ���ǿ����ϡ��Һ�з����кͷ�Ӧ����1molˮʱ�ų�������Ϊ�к��ȣ��ݴ�д���к��ȵ��Ȼ�ѧ����ʽ��
��������ǿ�Ӧ����ǿ�������Σ���Һ�Լ��ԣ�Ӧѡ�����ָʾ����
�ۼ���Ϊ���ᣬ���뷽��ʽΪHCOOH![]() HCOO-+ H+������100mL 0.2molL-1HCOOH��Һ����pHΪ4�Ļ�����Һ����
HCOO-+ H+������100mL 0.2molL-1HCOOH��Һ����pHΪ4�Ļ�����Һ����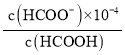 =1.8��10-4����֪c(HCOO-)=1.8c(HCOOH)��ԭ��Һ��n(HCOOH)=0.02mol�������xmolNaOH����x=1.8(0.02-x)��x=0.01286mol���ݴ˼����NaOH��Һ�������
=1.8��10-4����֪c(HCOO-)=1.8c(HCOOH)��ԭ��Һ��n(HCOOH)=0.02mol�������xmolNaOH����x=1.8(0.02-x)��x=0.01286mol���ݴ˼����NaOH��Һ�������
(2)�ٸ���ͼ֪��������ǿʱ��H3AsO3��Ũ�ȼ�С��H2AsO3-Ũ������˵�����H3AsO3����H2AsO3-����̪�ı�ɫ��Χ��8.2-10.0������Һ��PH��8.2��10.0֮��ʱ����Һ�Էۺ�ɫ���ݴ˷�����Ԫ�ص���Ҫ������ʽ��
��Ka1=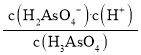 ��pH=2.2ʱc(H+)=10-2.2 mol/L��c(H3AsO3)=c(H2AsO3-)���ݴ˼����Ka1������pKa1=-lgKa1�ɼ���������
��pH=2.2ʱc(H+)=10-2.2 mol/L��c(H3AsO3)=c(H2AsO3-)���ݴ˼����Ka1������pKa1=-lgKa1�ɼ���������
(1)��ǿ���ǿ����ϡ��Һ�з����кͷ�Ӧ����1molˮʱ�ų�57.3kJ����������ѡ���������������ƣ����кͷ�Ӧ���Ȼ�ѧ����ʽΪ![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l) ��H=-57.3kJ/mol��
Na2SO4(aq)+H2O(l) ��H=-57.3kJ/mol��
�ʴ�Ϊ��![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l) ��H=-57.3kJ/mol��
Na2SO4(aq)+H2O(l) ��H=-57.3kJ/mol��
��������ǿ�Ӧ����ǿ�������Σ���Һ�Լ��ԣ�����ѡ�����Ϊָʾ�����ʴ�Ϊ��c��
�ۼ���Ϊ���ᣬ���뷽��ʽΪHCOOH![]() HCOO-+ H+������100mL 0.2molL-1HCOOH��Һ����pHΪ4�Ļ�����Һ����
HCOO-+ H+������100mL 0.2molL-1HCOOH��Һ����pHΪ4�Ļ�����Һ����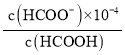 =1.8��10-4����֪c(HCOO-)=1.8c(HCOOH)��ԭ��Һ��n(HCOOH)=0.02mol�������xmolNaOH����x=1.8(0.02-x)��x=0.01286mol���������0.2molL-1NaOH��Һ�����Ϊ
=1.8��10-4����֪c(HCOO-)=1.8c(HCOOH)��ԭ��Һ��n(HCOOH)=0.02mol�������xmolNaOH����x=1.8(0.02-x)��x=0.01286mol���������0.2molL-1NaOH��Һ�����Ϊ![]() =0.0643L=64.3mL��
=0.0643L=64.3mL��
�ʴ�Ϊ��HCOOH![]() HCOO-+ H+��64.3��
HCOO-+ H+��64.3��
(2)�ٸ���ͼ֪��������ǿʱ��H3AsO3��Ũ�ȼ�С��H2AsO3-Ũ������˵�����H3AsO3����H2AsO3-����̪�ı�ɫ��Χ��8.2-10.0������Һ��PH��8.2��10.0֮��ʱ����Һ�Էۺ�ɫ����ʱ��Ԫ�ص���Ҫ������ʽΪH2AsO3-��H3AsO3��
�ʴ�Ϊ��H2AsO3-��H3AsO3��
��Ka1=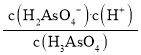 ��pH=2.2ʱc(H+)=10-2.2 mol/L��c(H3AsO3)=c(H2AsO3-)��pKa1=-lgKa1=-lg
��pH=2.2ʱc(H+)=10-2.2 mol/L��c(H3AsO3)=c(H2AsO3-)��pKa1=-lgKa1=-lg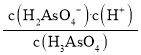 =2.2��
=2.2��
�ʴ�Ϊ��2.2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2.0molPCl3��1.0molCl2�������������ܱ������У���һ�������·���������Ӧ��PCl3(g)+Cl2(g)PCl5(g)��ƽ��ʱ��PCl5Ϊ0.4mol�������ʱ����1.0molPCl3��0.50molCl2������ͬ�¶����ٴ�ƽ��ʱPCl5�����ʵ����ǣ� ��
A. 0.4mol
B. 0.2mol
C. ��0.2mol
D. ����0.2mol����0.4mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������һ��ʵ��װ������ⱥ��ʳ��ˮ�������������������������(Լ6 mL)�ͼ���������������(��Ӧ��������������������)��
(1)�Դ���ͼ��ѡ�ü��ֱ�Ҫ������������һ����װ�ã����������ӿڵ�����˳��(����)��A��G-F-I��B��__________��
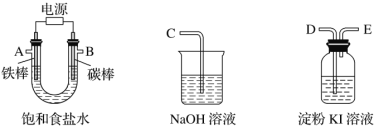
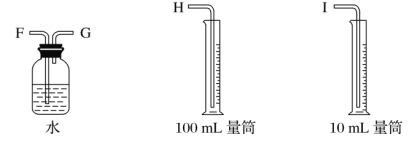
(2)������ֱ����Դ��________����̼���Ϸ����ĵ缫��ӦΪ_____________________________________��
(3)��˵���������������Ե�ʵ��������_______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶�����һ��������ܱ������У���������������Ϊ���淴ӦA(g)��3B(g) ![]() 2C(g)�ﵽƽ��״̬��־���� ( )
2C(g)�ﵽƽ��״̬��־���� ( )
��C������������C�������������
����λʱ��������a mol A��ͬʱ����3a mol B
��A��B��C��Ũ�Ȳ��ٱ仯
��C�����ʵ������ٱ仯
������������ѹǿ���ٱ仯
���������������ʵ������ٱ仯
����λʱ������a mol A��ͬʱ����3a mol B
��A��B��C�ķ�����֮��Ϊ1��3��2
A. �ڢ�B. �ܢ�C. �٢�D. �ݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������(K2FeO4)��һ��������ˮ��������25�棬��ˮ��Һ�м�����ı���Һ��pHʱ���������ӵ����ʵ���������(X)��pH�ı仯��ͼ��ʾ[��֪��(X)=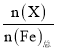 ]������˵����ȷ���ǣ� ��
]������˵����ȷ���ǣ� ��

A.K2FeO4��H2FeO4������ǿ�����
B.25�棬H2FeO4+H+![]() H3FeO4+��ƽ�ⳣ��K>100
H3FeO4+��ƽ�ⳣ��K>100
C.��B�����ݿ�֪��H2FeO4�ĵ�һ�����볣��Ka1=4.15��10-4
D.A��C�����Ӧ��Һ��ˮ�ĵ���̶����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ȩ��һ��ʳƷ���Ӽ�����������ľ����ԭ�Ϻϳɣ��ϳ�·�����£�
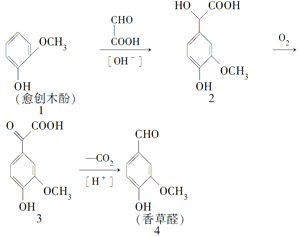
����˵������ȷ����(����)
A. ��Ӧ1��2��ԭ��������Ϊ90%
B. �����Ƶõ����ȩ���Ƿ���л�����3�������Ȼ�����Һ
C. ������2��һ�������¿ɷ���������Ӧ
D. �����ʵ��������ֻ�����ֱ�������NaOH��Һ��Ӧ������NaOH���ʵ���֮��Ϊ1��4��3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����X��Y��Z�ϳɻ���ҩ��M������˵������ȷ����
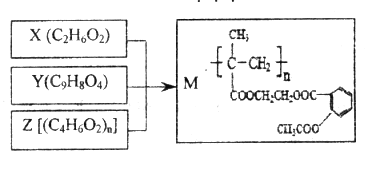
A. M�������ܻ�������ˮ�ⷴӦ
B. X��������ϩͨ���ӳɷ�Ӧ��ȡ����Ӧ�Ƹ�
C. 1molY��NaOH��Һ��Ӧ�����������3mol NaOH
D. Z�ɼӾ۷�Ӧ�Ƶã��䵥��Ľṹ��ʽ��CH3CH=CHCOOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��2RCH2CHO![]() RCH2CH=CRCHO��H2O��ˮ������EΪ�������ռ������������Ʒ�ɹ˪��E��һ�ֺϳ�·�����£�
RCH2CH=CRCHO��H2O��ˮ������EΪ�������ռ������������Ʒ�ɹ˪��E��һ�ֺϳ�·�����£�

��ش��������⣺
��1��һԪ��A��������������ԼΪ21.6%����A�ķ���ʽΪ_________���ṹ������ʾAֻ��һ������A������Ϊ___________��
��2��B�������Ƶ�Cu(OH)2������Ӧ���÷�Ӧ�Ļ�ѧ����ʽΪ___________________��
��3��C��____�ֽṹ����һ��ȡ��������C�����������ţ���ʹ�õ��Ⱥ�˳��д�������Լ���______________________________________________________��
��4�������ķ�Ӧ����Ϊ_________________��D���������ŵ�����Ϊ________________��
��5��д��ͬʱ��������������ˮ��������ͬ���칹��Ľṹ��ʽ��_________________________��
a�������к���6��̼ԭ����һ������ b�����������������Ű���ˮ������еĹ�����
��6���������ķ�Ӧ����Ϊ___________��д��E�Ľṹ��ʽ_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������仯����ѧ��������ʾ��������CO2Ũ��ÿ����һ������ʹ�ر�ƽ���¶�����56�档Ϊ��������ЧӦ�ļӾ磬�轫��ҵ�����в�����CO2��������������á��ش��������⣺
��1����500��ʱ��Li4SiO4���Ũ�ȵ�CO2��Ӧ����������Σ����÷�Ӧ�ﵽ��ѧ��Ӧ���Ⱥ�������700�棬������η�Ӧ�ų���Ũ�ȵ�CO2����Li4SiO4��ѭ�����á�д��700��ʱ������η�Ӧ�Ļ�ѧ����ʽ___��
��2��CO2��NH3��Ӧ�ɺϳɻ��ʡ�
����֪��2NH3(g)+CO2(g)=NH2COONH4(s) ��H=-159.5kJmol-1
NH2COONH4(s)=CO(NH2)2(s)+H2O(g) ��H=+116.5kJmol-1
H2O(l)=H2O(g) ��H=+44.0kJmo1-1
��CO2(g)+2NH3(g)=CO(NH2)2(s)+H2O(l)����H=___kJmol-1
�ڽ�����CO2ͨ�뱥�Ͱ�ˮ�п��Ƶ�̼�(NH4HCO3)����֪������Kb(NH3H2O)=1.8��10-5��Ka1(H2CO3)=4.3��10-7����0.0.1molL-1NH4HCO3��Һ�����³�___ (������������������������������)��
��3����һ�������£�CO2��H2�����ںϳɼ״���CO2(g)+3H2(g)CH3OH(g)+H2O(g)��������ɱ�ĺ�ѹ�ܱ������У��÷�Ӧ�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�[![]() ]��ƽ��ʱCO2��ת����[��(CO2)]��ͼ1��ʾ��
]��ƽ��ʱCO2��ת����[��(CO2)]��ͼ1��ʾ��
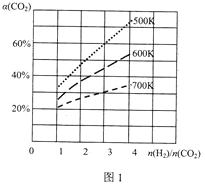
�÷�Ӧ����H___0(����>������=������<��)��
��500K��Ͷ�ϱ�[![]() ]=3ʱ��H2��ƽ��ת����Ϊ___������ѹǿΪP0����ѧƽ�ⳣ��Kp=___(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������)��
]=3ʱ��H2��ƽ��ת����Ϊ___������ѹǿΪP0����ѧƽ�ⳣ��Kp=___(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������)��
��ֱ�Ӽ״�ȼ�ϵ��(DMFC)�߱����¿���������ȼ�Ͻྻ�����Լ���ؽṹ�����ԡ��õ��ʹ�ú��ʵĺϽ�Ϊ�缫��������������Һ���״�������Ϊԭ�ϡ�д���为���缫��Ӧʽ___��
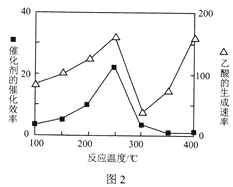
��4����TiO2/Cu2Al2O4Ϊ����ʱ��CO2��CH4�ɷ�Ӧ�������ᡣ�ڲ�ͬ�¶��´����Ĵ�Ч����������������ʵĹ�ϵ��ͼ2��ʾ��300��400��ʱ��Ӱ�������������ʵ���Ҫ������___(�����¶�������������)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com