
【题目】下列事实不能用勒夏特列原理解释的( )
A.常温下,将 1mL pH=3 的醋酸溶液加水稀释到 100mL,测得其 PH<5
B.红棕色的 NO2,加压后颜色先变深后变浅
C.工业合成氨中通常采取高温及加入催化剂,提高生产效益
D.实验室制取氨气利用浓氨水和固体氢氧化钠混合的方法
【答案】C
【解析】
A. pH=3的强酸稀释100倍,H离子总数不变,浓度变为原来的百分之一,pH=5,醋酸是弱酸,存在解离平衡,电离方程式HAc+H2O=H3O++Ac-,根据勒夏特列原理,用水稀释相当于增加反应物H2O的量,是平衡正向移动,H离子总数增加,浓度高于原浓度的百分之一,PH<5,故A正确;
B. 加压二氧化氮的浓度增大,平衡向生成四氧化二氮的方向移动,故加压后颜色先变深后变浅,但仍比原来的颜色深,可用勒夏特列原理解释,故B正确;
C. 催化剂不能使平衡移动,它只是缩短了到达平衡的时间,所以不能用勒夏特列原理解释,故C错误;
D. 浓氨水跟氢氧化钠混合能制氨气的原理是:在浓氨水中存在着电离平衡:NH3+H2O ![]() NH3·H2O
NH3·H2O ![]() NH4++OH-,当加入氢氧化钠固体,增大溶液中c(OH-),使氨水中的电离平衡向左移动;另外氢氧化钠固体溶解时能放热,使氨水溶液的温度升高,氨气溶解度减小而有大量氨气逸出,氨气减少,反应正向移动,可以用勒夏特列原理解释,故D正确;
NH4++OH-,当加入氢氧化钠固体,增大溶液中c(OH-),使氨水中的电离平衡向左移动;另外氢氧化钠固体溶解时能放热,使氨水溶液的温度升高,氨气溶解度减小而有大量氨气逸出,氨气减少,反应正向移动,可以用勒夏特列原理解释,故D正确;
故选C。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】下列实验中现象及得出的结论正确的是( )
实验 | 现象 | 结论 | |
A |
| 试管(1)中紫色褪去,试管(2)中紫色未褪 | 苯环使甲基的活性增强 |
B |
| 试管内壁有银镜生成 | 有机物X中一定是醛 |
C | 向淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜悬浊液并加热 | 未见砖红色沉淀 | 淀粉未水解 |
D |
| 最后一只试管中有浅黄色沉淀 | 有机物中含有溴原子 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丹参醇是存在于中药丹参中的一种天然产物。合成丹参醇的部分路线如下:
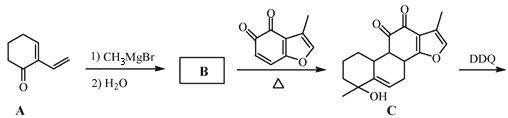
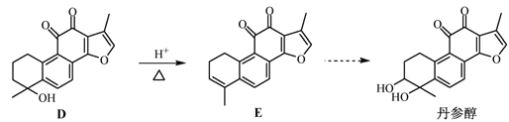
已知:①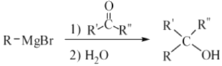 ②
②![]()
(1)A中的官能团名称为羰基和_______________。
(2)D![]() E的反应类型为__________反应。
E的反应类型为__________反应。
(3)B的分子式为C9H14O,则B的结构简式为_______________。
(4)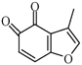 的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_______________。
的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_______________。
①能与FeCl3溶液发生显色反应; ②能发生银镜反应;
③核磁共振氢谱中有4个吸收峰,峰面积比为1:1:2:2。
(5)请补全以![]() 和
和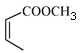 为原料制备
为原料制备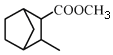 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
![]() 中间产物①__________
中间产物①__________![]() 中间产物②__________
中间产物②__________![]() 中间产物③__________反应物④ _______反应条件⑤__________
中间产物③__________反应物④ _______反应条件⑤__________![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示
溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示![]() 因逸出未画出,忽略因气体逸出引起的溶液体积变化
因逸出未画出,忽略因气体逸出引起的溶液体积变化![]() ,下列说法正确的是
,下列说法正确的是![]()
![]()
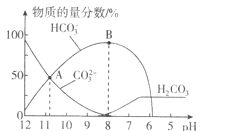
A.在![]() 溶液中:
溶液中:![]()
B.当溶液的pH为7时,溶液的总体积为![]()
C.在B点所示的溶液中,离子浓度最大的是![]()
D.在A点所示的溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 1g 氢气完全燃烧生成液态水时放出热量 143kJ,18g 水蒸气变成液态水放出 44kJ 的热量。其他相关数据如下表:则表中 x 为( )
O=O | H-H | H-O(g) | |
1mol 化学键断裂时需要吸收的能量/kJ | 496 | 436 | x |
A.920B.557C.463D.188
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】38.4 mg铜跟适量的浓硝酸反应,铜全部作用后,共收集到22.4 mL(标准状况下)气体,反应消耗的HNO3的物质的量可能是 ( )
A.1.0×10-3 molB.1.6×10-3 molC.2.2×10-3 molD.2.4×10-3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 俗称海波
俗称海波![]() 是常用的一种定影剂。工业使用的海波中常混有少量
是常用的一种定影剂。工业使用的海波中常混有少量![]() 和
和![]() 的杂质,为测定一种海波晶体样品的成分,某同学称取三份质量不同的该样品,分别加入相同浓度的稀硫酸20mL,充分反应后测得有关实验数据如下
的杂质,为测定一种海波晶体样品的成分,某同学称取三份质量不同的该样品,分别加入相同浓度的稀硫酸20mL,充分反应后测得有关实验数据如下![]() 标准状况
标准状况![]() 。
。
第一份 | 第二份 | 第三份 | |
样品的质量 |
|
|
|
二氧化硫的体积 |
|
|
|
硫的质量 |
|
|
|
下列说法错误的是 ![]()
![]()
A.第一份、第二份样品均完全反应,第三份样品过量
B.样品中![]() :
:![]() :1
:1
C.样品中除了含有![]() 、
、![]() ,还含有
,还含有![]()
D.所加硫酸溶液的物质的量浓度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HClO4、H2SO4、HCl和HNO3都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数,下列说法不正确的是
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | Ka1:6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
A.温度会影响这四种酸在冰醋酸中的电离常数
B.在冰醋酸中HClO4是这四种酸中最强的酸
C.在冰醋酸中H2SO4的电离方程式为H2SO4![]() 2H++
2H++![]()
D.这四种酸在冰醋酸中都没有完全电离,但仍属于强电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组设计了如图所示的数字化实验装置,研究常温下,向30 mL 0.1 mol·L1 H2A溶液中逐滴加入等浓度NaOH溶液时pH变化情况,并绘制出溶液中含A元素的微粒的物质的量分数与溶液pH的关系(如图所示),下列说法错误的是
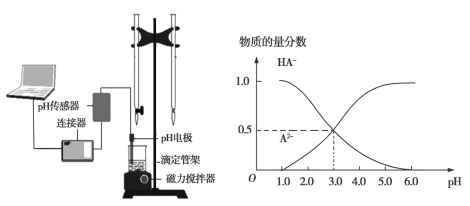
A. pH=4.0时,溶液中n(HA)约为2.73×104 mol
B. 该实验应将左边的酸式滴定管换成右边碱式滴定管
C. 常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0
D. 0.1 mol·L1NaHA溶液中存在c(A2)+c(HA)+c(H2A)=0.1 mol·L1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com