某校化学研究性学习小组在学习了金属的知识后,探究Cu的常见化合物的性质.过程如下:
【提出问题】
①在元素周期表中,Cu、Al位置接近,Cu不如Al活泼,Al(OH)
3具有两性,Cu(OH)
2也具有两性吗?
②通常情况下,Fe
2+的稳定性小于Fe
3+的,Cu
+的稳定性也小于Cu
2+的吗?
③CuO有氧化性,能被H
2、CO等还原,也能被NH
3还原吗?
【实验方案】
(1)解决问题①需用到的药品有CuSO
4溶液、
(填试剂名称,一种或多种),同时进行相关实验.
(2)解决问题②的实验步骤和现象如下:取98g Cu(OH)
2固体,加热至80~100℃时,得到80g黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A.冷却后称量,A的质量为72g,A的化学式为
.向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在,则反应的离子方程式为
.
(3)为解决问题③,设计的实验装置如图所示(夹持及尾气处理装置未画出):实验中观察到CuO变为红色物质.查资料可知,同时生成一种无污染的气体,该气体的化学式为
.
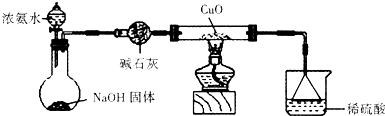
【实验结论】
(4)Cu(OH)
2具有两性.证明Cu(OH)
2具有两性的实验现象是
.
(5)根据实验方案(2),得出的Cu
+和Cu
2+稳定性大小的结论:高温时
;在酸性溶液中
.
(6)Cu0能被NH
3还原.
有同学认为NH
3与CuO反应后生成的红色物质是Cu,也有同学认为NH
3与CuO反应后生成的红色物质是Cu和A的混合物.请你设计一个简单的实验方案验证NH
3与CuO反应后生成的红色物质中是否含有A:
.




 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件均未列出).
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件均未列出).
