
 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件均未列出).
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件均未列出).
| ||
| ||
| ||
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| OH- |
| H+ |
| c(HCO3-):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
| A、正常人体血液中,HCO3-的水解程度大于电离程度 |
| B、人体血液酸中毒时,可注射NaHCO3溶液缓解 |
| C、pH=7.00的血液中,c(H2CO3)<c(HCO3-) |
| D、pH=7.40的血液中,HCO3-的水解程度一定大于H2CO3的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁片插入氯化铁溶液中:Fe3++Fe=2Fe2+ |
| B、少量金属钠放到硫酸铜溶液中:Cu2++2Na=Cu+2Na+ |
| C、少量金属钠放到冷水中:Na+2H2O=Na++OH-+H2↑ |
| D、氢氧化铜加到盐酸中:Cu(OH)2+2H+=Cu2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、OH-+HCO3-→CO32-+H2O |
| B、Ca2++OH-+HCO3-→CaCO3↓+H2O |
| C、Ca2++2OH-+2HCO3-→CaCO3↓+2H2O+CO32- |
| D、Ca2++3OH-+3HCO3-→CaCO3↓+3H2O+2CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
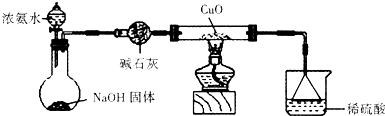
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、MnS的Ksp比CuS的Ksp大 | ||
| B、该反应达到平衡时c(Mn2+)=c(Cu2+) | ||
| C、往平衡体系中加入少量CuSO4固体后,C(Mn2+)变大 | ||
D、该反应的平衡常数K=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸、纯碱、石膏、臭氧 |
| B、氢硫酸、烧碱、绿矾、干冰 |
| C、石炭酸、乙醇、醋酸钠、水 |
| D、磷酸、熟石灰、苛性钾、过氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、根据原子守恒可推知,1个乙分子中含有2个A原子 |
| B、该反应类型是分解反应 |
| C、反应生成的乙物质属于化合物 |
| D、化学反应中分子的种类发生了改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
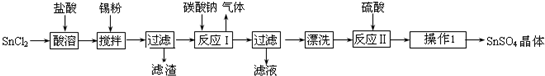
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com