
| A、8g | B、16g |
| C、20g | D、40g |
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Na+、Br-、SiO32- |
| B、H+、Fe2+、SO42-、Cl2 |
| C、K+、Ba2+、Cl-、NO3- |
| D、K+、Ag+、NH3?H2O、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | - 4 |
| O | 3- 4 |
| O | 2- 4 |
| O | 2- 3 |
| O | - 3 |
| O | - 2 |
| O | 2- 3 |
| O | - 3 |
| O | - 3 |
| H | + 4 |
| O | 2- 3 |
| H | + 4 |
| O | 2- 4 |
| O | - 4 |
| O | - 3 |
| O | 2- 4 |
| O | - 3 |
| A、①③ | B、②④⑤ |
| C、①②⑤ | D、③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁片插入氯化铁溶液中:Fe3++Fe=2Fe2+ |
| B、少量金属钠放到硫酸铜溶液中:Cu2++2Na=Cu+2Na+ |
| C、少量金属钠放到冷水中:Na+2H2O=Na++OH-+H2↑ |
| D、氢氧化铜加到盐酸中:Cu(OH)2+2H+=Cu2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 反应mA(s)+nB(g)?eC(g)+fD(g)反应过程中,当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是( )
反应mA(s)+nB(g)?eC(g)+fD(g)反应过程中,当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是( )| A、达到平衡后,加入催化剂,则C%增大 |
| B、该反应的△S<0,△H<0 |
| C、化学方程式中n<e+f |
| D、达到平衡后,增加A的量有利于平衡右移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
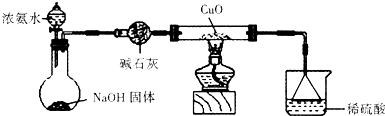
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓盐酸与铁屑反应:2Fe+6H+═2Fe3++3H2↑ |
| B、钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ |
| C、NaHCO3溶液与稀H2SO4反应:CO32-+2H+═H2O+CO2↑ |
| D、向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com