
【题目】某小组为研究电化学原理,设计甲、乙、丙三种装置(C1、C2、C3均为石墨)。下列叙述正确的是

A.甲、丙中是化学能转变为电能,乙中是电能转变为化学能
B.C1、C2分别是阳极、阴极,锌片、铁片上都发生氧化反应
C.C1上和C3上放出的气体相同,铜片上和铁片上放出的气体也相同
D.甲、乙、丙中溶液的pH都逐渐升高
科目:高中化学 来源: 题型:
【题目】(1)在某一容积为2L的密闭容器中,某一反应中A、B、C、D四种气体的物质的量n(mol)随时间t(min)的变化曲线如图所示:
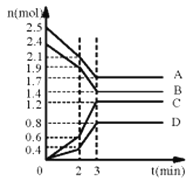
回答下列问题:
①该反应的化学方程式为___。
②前2min用A的浓度变化表示的化学反应速率为__。在2min时,图像发生改变的原因可能是__(填字母)。
a.增大压强 b.降低温度 c.加入催化剂 d.增加A的物质的量
(2)在100℃时,将0.01mol的N2O4气体充入0.1L的密闭容器中发生反应,隔一定时间对该容器内的物质进行分析,得到如下表格:
时间/s 浓度/mol·L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4)/mol·L-1 | 0.100 | 0.070 | 0.050 | a | b | c |
c(NO2)/mol·L-1 | 0.000 | 0.060 | d | 0.120 | 0.120 | 0.120 |
试填空:
①该反应的化学方程式__,达到平衡时N2O4的转化率为__。
②在0~20s内,四氧化二氮的平均反应速率为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色植物的光合作用,是地球表面上最普遍的化学变化,也是将___________能转化为________ 能的最主要途径。植物通过光合作用,将二氧化碳和水转化为葡萄糖(C6H12O6),并放出氧气,请写出该反应的化学方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是( )

A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)为用途极广的含铬化合物,可用于制备铬矾、火柴、铬颜料,并用于鞣革、电镀、有机合成等。铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备K2Cr2O2晶体的过程如图所示
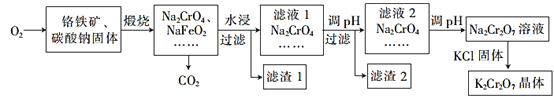
根据题意回答下列问题:
(1)煅烧时,铬铁矿发生复杂反应生成Na2CrO4和 NaFeO2,同时杂质SiO2、Al2O3与Na2CO3发生反应,其中Al2O3发生反应的化学方程式为___。
(2) NaFeO2遇水强烈水解生成滤渣1,反应的离子方程式为______。
(3)滤液1和滤液2均需调节溶液pH,滤液1调节pH为7~8的目的为_____;滤液2调节pH约为5的目的是_____。
物质 | 溶解度(g/100g) | ||
0℃ | 40℃ | 80℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
(4)向Na2Cr2O7溶液中加入KCl固体,析出K2Cr2O7晶体。分析此法能够制得K2Cr2O7晶体的原因:____;为了从溶液中得到较多K2Cr2O7晶体的操作过程是____、____、过滤、洗涤、干燥。
(5)KCr2O7产品含量测定:准确称取试样2.5g,配成250ml溶液,用移液管吸取25.00mL溶液于碘量瓶中,加入10mL2mol·L-1硫酸、2gKI,放于暗处5min,另加l00m水,用0.2000mol·L-1Na2S2O3标准液滴定至溶液呈黄绿色,再加人3mL淀粉溶液继续滴定至蓝色褪去并呈亮绿色。进行平行实验三次,平均消耗NaS2O3标准液的体积为25.00mL.K2Cr2O7产品的纯度为______。已知有关反应如下:![]() ;
;![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫的化合物在生产、生活中有广泛应用,其吸收和处理也十分重要。完成下列填空:
(1)SO2具有还原性,可以和许多氧化剂反应。SO2气体通入硫酸酸化的K2Cr2O7溶液中恰好生成铬钾矾[KCr(SO4)2·12H2O]。写出该反应的化学方程式_____________,反应中被还原的元素是__________。
(2)过量的SO2通入Na2S溶液,写出有关的离子方程式____________。
(3)在1L 0.3mol/L的NaOH溶液中,通入4.48LSO2(标况),反应后所得溶液中微粒的浓度之间有一些等量关系,例如:c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),请再写出两个等量关系:_______
(4)在室温下,下列曲线可以描述乙酸(甲、Ki=1.8×10﹣5)和次氯酸(乙、Ki=2.95×10﹣8)在水中的电离度与浓度关系的是_________。
A.
B.
C.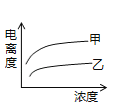
D.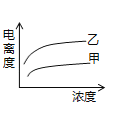
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材枓的生物相容性方面有很好的应用前景. PPG的一种合成路线如下:
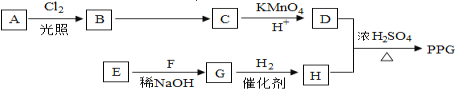
已知:
①烃A的相对分子质量为70,其一氯代物只有一种。
②化合物B为一氯代烃,化合物C的分子式为C5H8。
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质。
④R1CHO+R2CH2CHO
⑤R1CH2=CH2R2 →R1COOH+R2COOH
回答下列问题:
(1)A的结构简式为________________________________。
(2)B到C的反应条件________________________________。
(3)由E和F生成G的化学方程式为________________________,反应类型_________。
(4)由D和H生成PPG的化学方程式为___________________。
(5)写出D的最简同系物和H按1:1反应的产物______________________。
(6)写出G和新制的氢氧化铜溶液反应的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(N2H4)是一种绿色环保的还原剂,其氧化产物为氮气。
(1) 合成联氨的有关反应如下:
NH3(g)+NaClO(aq)=NH2Cl(l)+NaOH(aq) ΔH1=-67.45 kJ·mol-1
NH2Cl(l)+NaOH(aq)+NH3(g)=N2H4(l)+NaCl(aq)+H2O(l) ΔH2=-195.32 kJ·mol-1
反应2NH3(g)+NaClO(aq)=N2H4(l)+NaCl(aq)+H2O(l) ΔH=________kJ·mol-1。
(2) 联氨为二元弱碱,在水中的电离方式与氨相似,写出联氨与过量盐酸反应的离子方程式:________。
(3) 联氨—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。该电池放电时,负极的电极反应式是__________。
(4) 若用此碱性燃料电池作电源,电解AgNO3溶液,电解方程式为_________;若阴极析出5.40g金属银,则联氨—空气燃料电池中至少通入标准状况下空气体积________mL(假设空气中氧气体积分数为20%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com