
【题目】重铬酸钾(K2Cr2O7)为用途极广的含铬化合物,可用于制备铬矾、火柴、铬颜料,并用于鞣革、电镀、有机合成等。铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备K2Cr2O2晶体的过程如图所示
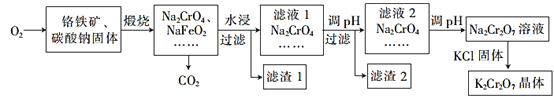
根据题意回答下列问题:
(1)煅烧时,铬铁矿发生复杂反应生成Na2CrO4和 NaFeO2,同时杂质SiO2、Al2O3与Na2CO3发生反应,其中Al2O3发生反应的化学方程式为___。
(2) NaFeO2遇水强烈水解生成滤渣1,反应的离子方程式为______。
(3)滤液1和滤液2均需调节溶液pH,滤液1调节pH为7~8的目的为_____;滤液2调节pH约为5的目的是_____。
物质 | 溶解度(g/100g) | ||
0℃ | 40℃ | 80℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
(4)向Na2Cr2O7溶液中加入KCl固体,析出K2Cr2O7晶体。分析此法能够制得K2Cr2O7晶体的原因:____;为了从溶液中得到较多K2Cr2O7晶体的操作过程是____、____、过滤、洗涤、干燥。
(5)KCr2O7产品含量测定:准确称取试样2.5g,配成250ml溶液,用移液管吸取25.00mL溶液于碘量瓶中,加入10mL2mol·L-1硫酸、2gKI,放于暗处5min,另加l00m水,用0.2000mol·L-1Na2S2O3标准液滴定至溶液呈黄绿色,再加人3mL淀粉溶液继续滴定至蓝色褪去并呈亮绿色。进行平行实验三次,平均消耗NaS2O3标准液的体积为25.00mL.K2Cr2O7产品的纯度为______。已知有关反应如下:![]() ;
;![]()
【答案】Na2CO3+Al2O3![]() 2NaAlO2+ CO2↑ FeO2-+2H2O =OH-+Fe(OH)3↓ 使NaAlO2、Na2SiO3反应生成Al(OH)3、H2SiO3除去 使Na2CrO4在酸性条件下转化为Na2Cr2O7 同温下,Na2CrO4的溶解度大于K2Cr2O7,冷却时会析出K2Cr2O7晶体 加热浓缩 冷却结晶 98%
2NaAlO2+ CO2↑ FeO2-+2H2O =OH-+Fe(OH)3↓ 使NaAlO2、Na2SiO3反应生成Al(OH)3、H2SiO3除去 使Na2CrO4在酸性条件下转化为Na2Cr2O7 同温下,Na2CrO4的溶解度大于K2Cr2O7,冷却时会析出K2Cr2O7晶体 加热浓缩 冷却结晶 98%
【解析】
由流程图可知,焙烧时发生反应铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,将铬铁矿和碳酸钠、氧气混合焙烧,发生反应:4 FeO·Cr2O3+8 Na2CO3+7O2![]() 8 Na2CrO4+ 2Fe2O3+8 CO2↑、Na2CO3+ SiO2
8 Na2CrO4+ 2Fe2O3+8 CO2↑、Na2CO3+ SiO2![]() Na2SiO3+ CO2↑、Na2CO3+Al2O3
Na2SiO3+ CO2↑、Na2CO3+Al2O3![]() 2NaAlO2+ CO2↑,然后水浸时发生NaFeO2+2H2O =NaOH+Fe(OH)3↓,过滤得到滤渣1和滤液1,Na2Cr2O7有强氧化性,滤液1中主要成分NaAlO2、Na2SiO3、Na2CrO4、NaOH,滤渣1为Fe(OH)3;将滤液1调节pH使NaAlO2、Na2SiO3反应生成Al(OH)3、H2SiO3,滤渣2 Al(OH)3、H2SiO3,滤液2主要是Na2CrO4,调节溶液pH使溶液呈酸性,溶质变为Na2Cr2O7,然后加入氯化钾固体,因为Na2CrO4的溶解度大于K2Cr2O7,所以得到K2Cr2O7晶体,采用过滤的方法得到K2Cr2O7晶体。
2NaAlO2+ CO2↑,然后水浸时发生NaFeO2+2H2O =NaOH+Fe(OH)3↓,过滤得到滤渣1和滤液1,Na2Cr2O7有强氧化性,滤液1中主要成分NaAlO2、Na2SiO3、Na2CrO4、NaOH,滤渣1为Fe(OH)3;将滤液1调节pH使NaAlO2、Na2SiO3反应生成Al(OH)3、H2SiO3,滤渣2 Al(OH)3、H2SiO3,滤液2主要是Na2CrO4,调节溶液pH使溶液呈酸性,溶质变为Na2Cr2O7,然后加入氯化钾固体,因为Na2CrO4的溶解度大于K2Cr2O7,所以得到K2Cr2O7晶体,采用过滤的方法得到K2Cr2O7晶体。
(1)根据题中的信息可知,Al2O3与Na2CO3反应生成NaAlO2,反应化学方程式为:Na2CO3+Al2O3![]() 2NaAlO2+ CO2↑;
2NaAlO2+ CO2↑;
(2)根据分析可知滤渣1为Fe(OH)3,反应的离子方程式为:FeO2-+2H2O =OH-+Fe(OH)3↓;
(3)滤液1调节pH使NaAlO2、Na2SiO3反应生成Al(OH)3、H2SiO3,达到除杂目的;滤液2调节pH约为5的目的是使Na2CrO4在酸性条件下转化为Na2Cr2O7;
(4)由图表中的数据可知同温下,Na2CrO4的溶解度大于K2Cr2O7,溶液中加入氯化钾固体,生成溶解度小的K2Cr2O7,K2Cr2O7晶体的溶解度受温度影响比较大,杂质能溶于水得到较多晶体操作是加热浓缩、冷却结晶、过滤、洗涤、干燥;K2Cr2O7晶体进一步提纯的操作是重结晶;
(5)根据所给的两个方程式可知道物质间的数量关系,由此确定关系式:K2Cr2O7![]() 3I2
3I2![]() 6 Na2S2O3,n(Na2S2O3)=(0.2000×25.00×10-3)mol,则样品中n(K2Cr2O7)=
6 Na2S2O3,n(Na2S2O3)=(0.2000×25.00×10-3)mol,则样品中n(K2Cr2O7)=
![]() ,则纯度为:
,则纯度为:![]() =98% 。
=98% 。


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】三位化学家因研究锂电池做出开创性贡献而获得2019年诺贝尔化学奖。磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点;成为目前广泛使用的锂电池。
(1)铁元素在元素周期表中的位置__;LiFePO4中Fe2+基态电子排布式是__。
(2)P的电负性___O的电负性(填写“大于”“小于”或“等于”);PO43-的空间构型是__,中心原子的杂化方式是___。
(3)Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是__。
(4)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为__,其中Fe的配位数为__。
(5)有一种蓝色晶体[可表示为:KFex(CN)6,相对分子质量为Mr],经研究发现,其晶胞的![]() 如图所示(K+未画出)。
如图所示(K+未画出)。
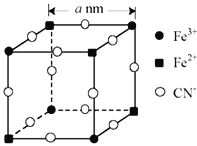
①晶体中与每个Fe3+距离最近且等距离的CN-有__个。
②该晶体的化学式为__。
③若晶胞中每个Fe3+和Fe2+距离用anm表示,则晶体的密度表达式是__g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石的主要成分为Cu2(OH)2CO3(含少量FeO、Fe2O3、SiO2)。某小组同学在实验室以孔雀石为原料制备胆矾,并测定所得胆矾中结晶水的含量。实验步骤如下:
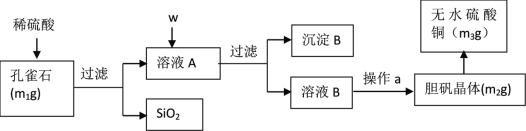
(提供试剂:NaOH溶液、 H2O2溶液、 CuO 、Na2CO3)
完成下列填空:
(1)孔雀石的主要成分与稀硫酸反应的离子方程式为________。
(2)按试剂加入顺序,w所代表的试剂依次为__________。沉淀B的成分为_______。
(3)a操作依次为:加热蒸发、_______、过滤、洗涤、__________。除烧杯、漏斗之外过滤还需要另一玻璃仪器,该仪器在此操作中的主要作用是_________。
(4)欲检验溶液A中Fe2+的试剂是___________(选填序号)。如果测定Fe2+的含量,需要用容量瓶配制某标准溶液,请简述配制中“定容”的操作:_____。
a NaOH(aq) b Na2CO3(aq) c 淀粉KI(aq) d 酸性KMnO4(aq)
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中,若测定结果的实验误差为1.5%,可能的原因是_______________。
a 加热温度过高 b 胆矾晶体的颗粒较大
c 加热后放在空气中冷却 d 加热胆矾晶体时有晶体从坩埚中溅出
(6)该小组一位同学根据实验结果求出样品中孔雀石的质量分数为: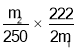 ,另一位同学不同意,其原因是___________。
,另一位同学不同意,其原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化妆品的组分Z具有美白功效,原从杨树中提取,现可用如下反应制备:

下列叙述错误的是
A. X、Y和Z均能使溴水褪色
B. X和Z均能与NaHCO3溶液反应放出CO2
C. Y既能发生取代反应,也能发生加成反应
D. Y可作加聚反应单体,X可作缩聚反应单体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组采用电渗析法从含NH4H2PO4 和(NH4)2HPO4的废水中回收NH3·H2O和 H3PO4,装置如图所示。下列说法错误的是( )
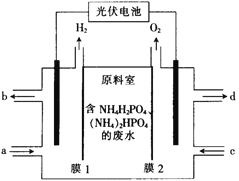
A.膜1为阳离子交换膜,膜2为阴离子交换膜
B.a处进入稀氨水,d处流出浓H3PO4溶液
C.阴极区总反应式为2H2O+2NH4++2e-=2NH3·H2O+H2↑
D.每放出11.2L(标准状况)H2时,能回收98gH3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计甲、乙、丙三种装置(C1、C2、C3均为石墨)。下列叙述正确的是

A.甲、丙中是化学能转变为电能,乙中是电能转变为化学能
B.C1、C2分别是阳极、阴极,锌片、铁片上都发生氧化反应
C.C1上和C3上放出的气体相同,铜片上和铁片上放出的气体也相同
D.甲、乙、丙中溶液的pH都逐渐升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,有如下实验现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面。以下有关解释不合理的是

A. 生铁片中所含的碳能增强铁的抗腐蚀性
B. 雨水酸性较强,生铁片开始发生析氢腐蚀
C. 导管内墨水液面回升时,正极反应式:O2+2H2O+4e—==4OH-
D. 随着反应的进行,U型管中雨水的酸性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaHCO3和Na2O2的固体混合物x g在密闭容器中加热至250℃,充分反应后排出气体.将反应后的固体溶入水无气体放出,再逐滴加入盐酸,产生气体(标准状况)与所加盐酸体积之间的关系如图所示.下列说法错误的是( )
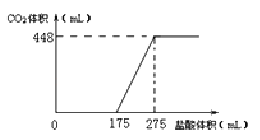
A.HCl的浓度0.2mol/L
B.反应后固体的成分为NaOH与Na2CO3
C.密闭容器中排出气体的成分为O2和H2O
D.x的数值为6.09
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种镁氧电池如图所示,电极材料为金属镁和吸附氧气的活性炭,电解液为KOH浓溶液。下列说法不正确的是( )

A.电池总反应式为:2Mg+ O2+2H2O=2Mg(OH)2
B.正极反应式为:Mg-2e-=Mg2+
C.活性炭可以加快O2在电极上的反应速率
D.电子的移动方向由a经外电路到b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com