
����Ŀ��������һƿ�������Һ�����п��ܺ���H+��NH4+��Mg2+��Ba2+��Al3+��I����NO3����CO32����SO42����AlO2����ȡ����Һ��������ʵ�飺
��1��ȡpH��ֽ���飬��Һ�����ԣ������ų�______________�Ĵ��ڣ�
��2��ȡ��������Һ����������CCl4������������ˮ������CCl4���Ϻ�ɫ�������ų�_______���ڣ�
��3����ȡ��������Һ����NaOH��Һ��ʹ��Һ��������Ϊ���ԣ���Ӧ�����о��������������ֿ��ų�____________�Ĵ��ڣ�
��4��ȡ����������������Һ��Na2CO3��Һ���а�ɫ�������ɣ�֤����_______�Ĵ��ڣ��ֿ����ų�__________�Ĵ��ڣ�
��5����������ʵ����ʵ����ȷ��������Һ�п϶����ڵ�������____________��������ȷ���Ƿ���ڵ�������_______________��
����ij����� A������ KAl(SO4)2��Al2O3 �� Fe2O3����һ�������¿�ʵ����ͼ��ʾ������֮��ı仯��
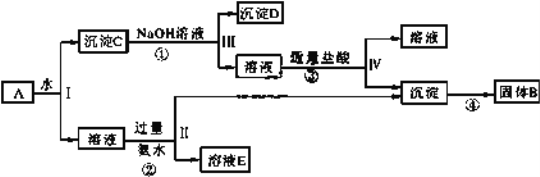
�ݴ˻ش��������⣺
��1�����IJ��ж�����Һ�ͳ����ķ����ȡ�ķ�����__________��
��2������������ͼ��Ӧ��ϵ��д������B��C��D �������ʵĻ�ѧʽ(��ʾ����Ϊ�����)��
���� B_________������ C__________������ D _________��
��3��д�������ڷ�Ӧ���ӷ���ʽ��
��___________________________________________��
��___________________________________________��
��4������۽��Ѳ�������ν�ʵ�鷽�����иĽ���________________________��
���𰸡�CO32����AlO2�� NO3�� Mg2+��Al3+ Ba2+ SO42�� H+��I����Ba2+ NH4+ ���� Al2O3 Al2O3��Fe2O3 Fe2O3 Al2O3+ 2 OH-=2AlO2-+H2O Al3+��3NH3��H2O=Al(OH)3����3NH4+ ��NaAlO2��Һ��ͨ�������CO2��������ȫ���𰸺���������
��������
I�����⿼�����Ӽ�����棬��1����Һ�����ԣ�˵����Һ�к��д���H����H����CO32�����ܴ������棬H����AlO2�����ܴ������棬һ�����ܴ�����CO32����AlO2������2����������CCl4������������ˮ��CCl4�����Ϻ�ɫ��˵��ԭ��Һ��I����NO3�������������¾���ǿ�����ԣ��ܰ�I�����������ԭ��Һ��һ��û��NO3������3����ȡ������Һ������NaOH��Һ��ʹ��Һ��������Ϊ���ԣ���Ӧ�����о�������������ԭ��Һ�в���Mg2����Al3������4��ȡ��3������Һ������̼������Һ�����ְ�ɫ�������˳���ӦΪBaCO3��˵��ԭ��Һ�к���Ba2������ΪBa2����SO42����Ӧ���ɳ�������ԭ��Һ�в���SO42������5����������������һ�����е�������H����I����Ba2��������ȷ����������NH4����II.��1����������ͼ���IJ�������Һ�ͳɵ�ķ��뷽���ǹ��ˣ���2��Al2O3��Fe2O3������ˮ��KAl(SO4)2����ˮ���Ƴ�����CΪAl2O3��Fe2O3������C�м���NaOH��Һ����Ϊ������Ϊ���������������Ϊ���������������Al2O3��2OH��=2AlO2����H2O�������DΪFe2O3����Ӧ�ڷ���Al3����3NH3��H2O=Al(OH)3����3NH4������Ӧ��ΪAl2O3��2OH��=2AlO2����H2O����Ӧ��ΪAlO2����H����H2O=Al(OH)3������Ӧ�����������ֽ����������������BΪAl2O3����3������������������Ӧ�ٵ����ӷ���ʽΪAl2O3+ 2 OH-=2AlO2-+H2O����Ӧ�ڵ����ӷ���ʽΪ Al3����3NH3��H2O=Al(OH)3����3NH4������4����������Ϊ���ԣ�����������������Al(OH)3��3H��=Al3����3H2O���Ľ���������NaAlO2��Һ��ͨ�������CO2��������ȫ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ݻ��̶����ܱշ�Ӧ�����м���һ���������ƶ��ĵ��ȵĸ��彫�����ֳɼס��������֣��ֱ��������������淴Ӧ��

�ף�a(g)��b(g)![]() 2c(g) ��H1<0���ң� x(g)��3y(g)
2c(g) ��H1<0���ң� x(g)��3y(g)![]() 2z(g) ��H2>0
2z(g) ��H2>0
����ס��Ҿ��ﵽ��Ӧƽ������λ�����м䣬Ȼ�������ز��������������������
A. �ڷ�Ӧ�������£�������ͨ��z���壬c�����ʵ���Ũ������
B. �ڷ�Ӧ�������£������ͨ��������壬����x��y��ת��������
C. �ڷ�Ӧ�������£�������ͨ��z���壬��Ӧ�����¶�����
D. �ڷ�Ӧ�������£������ͨ��������壬c�����ʵ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����A��I֮���ת����ϵ������ͼ��ʾ������A��C��F��G��IΪ������������ɫ��Ӧ��Ϊ��ɫ��AΪ��ˮ����Ҫ���ʣ�BΪ�����³���Һ�壻EΪ����ɫ���壬H����ɫ��ζ����ʹ����ʯ��ˮ����ǵ����壮
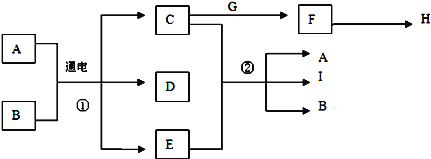
�Իش��������⣺
��1��D�Ļ�ѧʽΪ__________��
��2����Ӧ�ٵĻ�ѧ����ʽΪ��____________________________��
��3����Ӧ�ڵ����ӷ���ʽΪ��____________________________��
��4��д��þ����H������ȼ�յķ�Ӧ����ʽΪ��___________________________��
��5��G��ˮ�еĵ��뷽��ʽ_____________________________��
��6����A��I��B�Ļ�����м���ϡ���ᣬ�л���ɫ���������д���÷�Ӧ�Ļ�ѧ����ʽ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У����ܸ����ᷴӦ�����ܸ�NaOH��Һ��Ӧ���ǣ� ��
A.NaHCO3
B.Fe2O3
C.Al2O3
D.SiO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�Ӧ3S+6KOH ![]() 2K2S+K2SO3+3H2O������˵����ȷ����
2K2S+K2SO3+3H2O������˵����ȷ����
A. S����������KOH�ǻ�ԭ�� B. ��3mol����ȫ��Ӧ����Ӧ�й�ת����4mol���� C. ��ԭ��������������������2:1 D. ��������ͻ�ԭ��������ʵ���֮��Ϊ3:2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ����( )
A.�л���C2H6��C3H8һ����ͬϵ��B.��������ˮ����������ϩ
C.�÷�Һ©������������Ҵ�D.���Ǻ���ѿ�ǻ���Ϊͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ��(������Ϊ���Ե缫)������SO2�����������ų�����Һ����NO2�����й��ڸ�װ��������˵������ȷ�������

��.aΪֱ����Դ�ĸ���
��.�����ĵ缫��ӦʽΪ��2HSO3-+2H++2e-=S2O42-+2H2O
��.�����ĵ缫��ӦʽΪ��SO2+2H2O-2e-=SO42-+4H+
��.���ʱ��H+��������ͨ�������ӽ���Ĥ��������
A. ������ B. ������
C. �ں͢� D. �ۺ͢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I�� A�� B�� C�� D�� E ��Ϊ��ѧ��ѧ�����Ĵ���� B Ϊ���Һ�壬����֮�������µķ�Ӧ��ϵ��
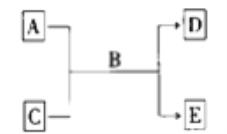
��1���� A Ϊ�����ڵĽ������ʣ� D Ϊ��̬���ʣ� 0.1 mol�� L-1 C ��Һ�� pH=13����÷�Ӧ�����ӷ���ʽΪ_______________________________________��
��2���� A ����Һ��ʹ������Һ������ C Ϊ�ǽ�������� ����ʹƷ����Һ��ɫ�� ��÷�Ӧ�Ļ�ѧ����ʽΪ_______________________________________��
��3���� A�� C�� D�� E ��Ϊ����� E Ϊ��ɫ��״�������� A�� C�� E ������ͬһ��Ԫ�أ� ��÷�Ӧ�����ӷ���ʽΪ_____________________________________��
��4�������� A �����õİ뵼����ϣ���д����ҵ����ȡ���� A ��Ʒ�Ļ�ѧ����ʽΪ________________________��
II����5������������Ŀǰ�����Ϲ��ϵĵ��Ĵ���Ч�����Ĺ����������������� KClO3 �� H2SO4��������Na2SO3 ��Ӧ�Ƶá���д���÷�Ӧ�����ӷ���ʽ___________________________________________________________________��
��6����̼������һ���ж���;��������ϵ��̬Ư������ѧʽ�ɱ�ʾΪ Na2CO3��3H2O2�������� Na2CO3�� H2O2��˫�����ʡ���̼�������������ʾ��ᷢ����ѧ��Ӧ��ʧЧ�����й�̼����ֻ�����˻�ԭ��Ӧ����______ ������ĸ����
A��MnO2 B��KMnO4��Һ C��ϡ���� D�� Na2SO3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���һ������A��B��������ܱ�������������Ӧ��A(g)+B(g)![]() xC(��)+3D(��)����Ӧƽ��ı�Ӱ��ƽ���һ������������A��Ũ�ȱ仯����ͼ��ʾ�������й�˵����ȷ����
xC(��)+3D(��)����Ӧƽ��ı�Ӱ��ƽ���һ������������A��Ũ�ȱ仯����ͼ��ʾ�������й�˵����ȷ����
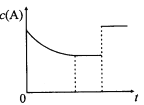
A��x=2��CΪ��̬��D����Ϊ��̬Ҳ����Ϊ����̬
B���ı������������ʹ���˴���
C�������������䣬���������м�������C��A��ƽ��ת���ʲ���
D���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=[c(C)]2/c(A) ��c(B)�����¶����ߣ�Kֵ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com