
【题目】下列叙述不正确的是( )
A.有机物C2H6与C3H8一定是同系物B.可以用溴水鉴别甲烷和乙烯
C.用分液漏斗分离乙酸和乙醇D.蔗糖和麦芽糖互称为同分异构体
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于苯的说法不正确的是
A.苯分子中所有原子在同一平面上B.苯燃烧火焰明亮伴有浓烈的黑烟
C.苯中无碳碳双键,故不能发生加成反应D.苯可发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】aLCO2气体通过足量Na2O2后,所得气体再与bLNO混合时,可得到cL气体(气体体积均在相同状况下测定),下列表达式中,错误的是( )
A. 若a则c<![]() (a+b) B. 若a则c>
(a+b) B. 若a则c>![]() (a+b)
(a+b)
C. 若a>b则c=![]() (a+b) D. 若a=b则c=
(a+b) D. 若a=b则c=![]() (a+b)
(a+b)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、有一瓶澄清的溶液,其中可能含有H+、NH4+、Mg2+、Ba2+、Al3+、I﹣、NO3﹣、CO32﹣、SO42﹣、AlO2﹣,取该溶液进行以下实验:
(1)取pH试纸检验,溶液呈酸性,可以排除______________的存在.
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4呈紫红色,可以排除_______存在.
(3)另取出部分溶液逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,反应过程中均无沉淀产生,则又可排除____________的存在.
(4)取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成,证明有_______的存在,又可以排除__________的存在.
(5)根据上述实验事实可以确定,该溶液中肯定存在的离子是____________,还不能确定是否存在的离子是_______________.
Ⅱ、某混合物 A,含有 KAl(SO4)2、Al2O3 和 Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
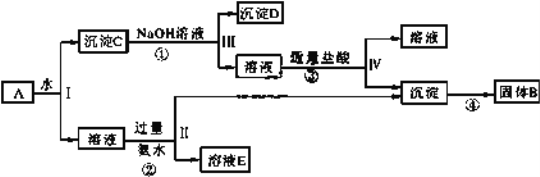
据此回答下列问题:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是__________。
(2)根据上述框图反应关系,写出下列B、C、D 所含物质的化学式(提示:可为混合物)。
固体 B_________;沉淀 C__________;沉淀 D _________;
(3)写出①、②反应离子方程式。
①___________________________________________;
②___________________________________________;
(4)步骤③较难操作,如何将实验方案进行改进?________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列反应判断有关物质还原性由强到弱的顺序是( )
①H2SO3+I2+H2O![]() 2HI+H2SO4
2HI+H2SO4
②2FeCl3+2HI![]() 2FeCl2+2HCl+I2
2FeCl2+2HCl+I2
③3FeCl2+4HNO3![]() 2FeCl+NO+2H2O+Fe(NO3)3
2FeCl+NO+2H2O+Fe(NO3)3
A. H2SO3>I->Fe2+>NO B. I->Fe2+>H2SO3>NO C. Fe2+>I->H2SO3>NO D. NO>Fe2+>H2SO3>I-
【答案】A
【解析】
试题依据还原剂的还原性>还原产物的还原性,反应2FeCl3+2HI==2FeCl2+2HCl+I2 中还原性I-> Fe2+,反应H2SO3+I2+H2O===2HI+H2SO4中还原性H2SO3> I-,反应3FeCl2+4HNO3==2FeCl3+NO↑+2H2O+Fe(NO3)3中还原性Fe2+> NO,综上分析可得还原性H2SO3> I-> Fe2+> NO,答案选A。
考点:考查氧化性、还原性强软的比较
【题型】单选题
【结束】
26
【题目】(1)下列物质:①.Cu ②.NaCl晶体 ③.NaHSO4 ④.CO2 ⑤.CaO ⑥HCl ⑦.稀H2SO4 ⑧. 熔融Ba(OH)2 ⑨.C2H5OH ⑩.NaCl溶液。
属于电解质的是(填序号,下同)_____,属于非电解质的是_____,能导电的是______。
(2)写出下列物质在水溶液中的电离方程式:
①NaHSO4 ___________________________;
②Al2(SO4)3 ________________________________;
③NH4NO3 ________________________。
(3)按要求写出下列方程式:
①写出硫酸铜溶液中滴加氢氧化钠溶液的反应的离子方程式:_____________。
②写出能用离子方程式CO32-+2H+=CO2↑+H2O表示的一个化学方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以反应 5H2C2O4+2MnO4 -+6H+ = 10CO2↑+ 2Mn2+ + 8H2O 为例探究“外界条件对化学反应速率的影响”。实验时,分别量取 H2C2O4 溶液和酸性 KMnO4溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。
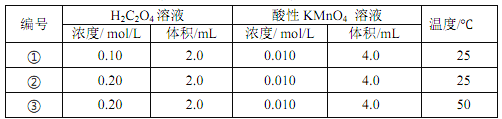
下列说法不正确的是
A. 实验①、 ②、 ③所加的H2C2O4 溶液均要过量
B. 若实验①测得 KMnO4溶液的褪色时间为 40 s, 则这段时间内平均反应速率 v(KMnO4)= 2. 5×10-4 mol/L/s
C. 实验①和实验②是探究浓度对化学反应速率的影响, 实验②和③是探究温度对化学反应速率的影响
D. 实验①和②起初反应均很慢,过了一会儿速率突然增大,可能是生成的 Mn2+对反应起催化作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于金属腐蚀,下列说法正确的是
A. 金属的化学腐蚀比电化学腐蚀更普遍
B. 析氢腐蚀比吸氧腐蚀更普遍
C. 析氢腐蚀后阶段会发生吸氧腐蚀
D. 牺牲阳极的阴极保护法是利用了电解原理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用18.4mol/L的浓H2SO4配制100mL浓度为1.0mol/L的稀H2SO4,其操作可分为以下各步:
(1)A.用量简量取_____浓H2SO4缓缓注入装有约50mL蒸馏水的烧杯中,并用玻璃棒搅拌;
B.用约30mL蒸馏水,分成3次洗涤烧杯和玻棒,将每次洗涤液都注人容量瓶中;
C.将稀释后的H2SO4小心转移到100mL容量瓶里;
D.检查100mL容量瓶口部是否会发生滴漏;
E.加蒸馏水至容量瓶中液面接近刻度2cm处;
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液;
G.用胶头滴管向容量瓶里逐滴滴加蒸馏水至液面最低点和刻度线相平。
(2)上述操作正确的顺序为(用字母填写)__________。
(3)进行A步操作时,应选择下列量器_______(填序号)。
a.10mL量筒 b.50mL量筒 c.100mL量筒
(4)如果对装有浓H2SO4的量筒读数如右图所示,配制的稀H2SO4的浓度将_______(偏高、偏低、无影响)。
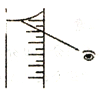
(5)进入A步操作后,必须________后才能进行C操作。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com