
【题目】关于金属腐蚀,下列说法正确的是
A. 金属的化学腐蚀比电化学腐蚀更普遍
B. 析氢腐蚀比吸氧腐蚀更普遍
C. 析氢腐蚀后阶段会发生吸氧腐蚀
D. 牺牲阳极的阴极保护法是利用了电解原理
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】Q、X、Y、Z、W 五种元素的原子序数依次递增,W 为第四周期元素,其余均为短周期主族元素,已知:
①Q原子的最外层电子数是次外层电子数的2 倍
②Y、Z同主族,Y原子价电子排布图为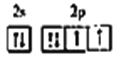 ;
;
③W元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。
请回答下列问题:
(1)基态Q 原子中,电子运动状态有_____种,电子占据的最高能级符号为_____,该能级含有的轨道数为________
(2)W的元素名称为_____,其基态原子的电子排布式为________
(3)具有相同价电子数和相同原子数的分子或离子具有相同的结构特征,这一原理称为“等电子原理”,五种元素中电负性最强的非金属元素形成的一种单质A 与Y、Z 形成的化合物B 是等电子体物质,A、B分子式分别为______、_______。
(4)Q、X、Y三种元素的第一电离能数值最大的是_____(用元素符号作答),原因是______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.有机物C2H6与C3H8一定是同系物B.可以用溴水鉴别甲烷和乙烯
C.用分液漏斗分离乙酸和乙醇D.蔗糖和麦芽糖互称为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一些食物的近似pH值如下表:
食物 | 苹果 | 葡萄 | 牛奶 | 玉米粥 |
pH | 2.9-3.3 | 3.5-4.6 | 6.3-6.6 | 6.8-8.0 |
人的胃液中含有盐酸,对于胃酸过多的人,空腹时最宜食用的是
A. 苹果 B. 葡萄 C. 牛奶 D. 玉米粥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. A、 B、 C、 D、 E 均为中学化学常见的纯净物, B 为最常见液体,它们之间有如下的反应关系:
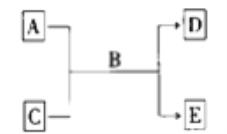
(1)若 A 为短周期的金属单质, D 为气态单质, 0.1 mol· L-1 C 溶液的 pH=13,则该反应的离子方程式为_______________________________________。
(2)若 A 的溶液能使淀粉溶液变蓝, C 为非金属氧化物, 且能使品红溶液褪色, 则该反应的化学方程式为_______________________________________。
(3)若 A、 C、 D、 E 均为化合物, E 为白色胶状沉淀,且 A、 C、 E 均含有同一种元素, 则该反应的离子方程式为_____________________________________。
(4)若单质 A 是良好的半导体材料,请写出工业上制取单质 A 粗品的化学方程式为________________________。
II.(5)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由 KClO3 在 H2SO4存在下与Na2SO3 反应制得。请写出该反应的离子方程式___________________________________________________________________。
(6)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为 Na2CO3·3H2O2,它具有 Na2CO3和 H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了还原反应的是______ (填字母)。
A.MnO2 B.KMnO4溶液 C.稀盐酸 D. Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 在NH![]() 和[Cu(NH3)4]2+中都存在配位键
和[Cu(NH3)4]2+中都存在配位键
B. H2O是极性分子,分子中O原子不处在2个H原子所连成的直线的中央
C. SO2、SO3、BF3、NCl3都是极性分子
D. 向含有0.1 mol [Co(NH3)4Cl2]Cl的水溶液中加入足量AgNO3溶液只能生成0.1 mol AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镁(Mg3N2)在工业上具有非常广泛的应用。某化学兴趣小组用镁与氮气反应制备 Mg3N2 并进行有关实验。实验装置如下所示: (部分加热装置已略去)
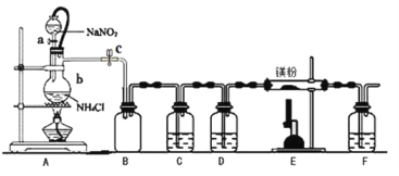
已知:①氮化镁常温下为浅黄色粉末,极易与水反应。
②亚硝酸钠和氯化铵制取氮气的反应剧烈放热,产生氮气的速度较快。
③温度较高时,亚硝酸钠会分解产生O2等。
回答下列问题:
(1)仪器 b 的名称是__________,写出装置 A 中发生反应的化学方程式___________。
(2)某同学检验装置 A 部分的气密性,关闭止水夹 c 后,开启活塞 a,水不断往下滴,直至全部流入烧瓶。试判断:
A 部分装置是否漏气? ________ (填“漏气”、“不漏气”或“无法确定”),判断理由是____________。
(3)装置 C 中为饱和硫酸亚铁溶液, 其作用是___________,装置 F 的作用是________。
(4)加热至反应开始发生,需移走 A 处酒精灯,原因是__________________。
(5)定性分析产物
操作步骤 | 实验现象 | 解释原因 |
取少量产品于试管中, 加适量蒸馏水 | 试管底部有固体不溶物,有剌激性气味的气体产生 | 反应的化学方程式为 __________________________________ |
弃去上层淸液, 加入足量稀盐酸 | 观察到固体全部溶解, 且有气泡冒出 | 气泡冒出的原因为___________________________________________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中的每一方框内表示一种反应物或生成物,其中A、C、D、E、F在通常情况下均为气体,且A与C物质的量之比为1:1,B为常见液体。
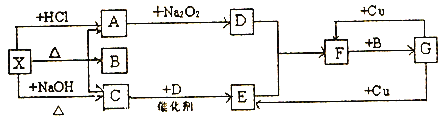
试回答下列问题:
(1)X是_____;F是____。(写化学式)
(2)写出C→E反应的化学方程式并用双线桥标出电子转移的方向和数目__________。
(3)G与Cu的反应中,G表现_______性质。
(4)写出X→A的离子方程式:__________。
(5)以C、B、D为原料可生产G,若使amolC的中心原子完全转化到G中,理论上至少需要D___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
(1)N2H62+在碱性溶液中反应的离子方程式:_____________________________________。
(2)NH2-的电子式为__________________________,NH2-的构型为____________。
(3)写出一种与N3-是等电子体的微粒化学式___________。
(4)据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为 “盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N![]() N键。则“N5”分子碎片所带电荷是_______。
N键。则“N5”分子碎片所带电荷是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com