
【题目】实验是探究化学过程的重要途径,有关下列各实验装置图的叙述正确的是( )

![]()
A. 图I可用于探究 NaHCO3固体的热稳定性
B. 图Ⅱ用于从氯化钠溶液中获得晶体
C. 图III中b口进气可收集Cl2、CO2等气体
D. 图Ⅳ中若X为NaOH溶液,则可完成SO2的喷泉实验
科目:高中化学 来源: 题型:
【题目】下列变化不能用勒夏特列原理解释的是( )
A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B.H2、I2(g)混合气体加压后颜色变深
C.红棕色的NO2加压后颜色先变深再变浅
D.实验室用排饱和食盐水的方法收集氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以绿矾(FeSO4·7H2O)制备补血剂甘氨酸亚铁[(NH2CH2COO)2Fe] 有关物质性质如下:
甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程:
Ⅰ.配制含0.10mol FeSO4的绿矾溶液。
Ⅱ.制备FeCO3:向配制好的绿矾溶液中,缓慢加入200mL 1.1mol·L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
Ⅲ.制备(NH2CH2COO)2Fe:实验装置如下图(夹持和加热仪器已省略),将实验Ⅱ得到的沉淀和含0.20 mol甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
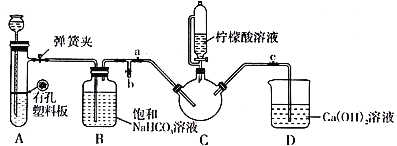
回答下列问题:
(1)实验I中:实验室配制绿矾溶液时,为防止FeSO4被氧化变质,应加入的试剂为_______(写化学式)。再滴加少量稀硫酸的作用是__________________________。
(2)实验II中:生成沉淀的离子方程式为__________________________。
(3)实验Ⅲ中:①C中盛柠檬酸溶液的仪器名称为___________________。
②装置A中所盛放的药品是___________________。(填序号)
A.Na2CO3和稀H2SO4 B.CaCO3和稀H2SO4 C.CaCO3和稀盐酸
③确认C中空气排尽的实验现象是____________________。
④加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是________________。
⑤洗涤实验Ⅲ中得到的沉淀,所选用的最佳洗涤试剂是___________________。(填序号)
A.热水 B.乙醇溶液 C.柠檬酸溶液
⑥若产品的质量为17.34g,则产率为________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5molL﹣1的盐酸10mL稀释到200mL,从中取出5mL,这5mL溶液的物质的量浓度为( )
A.0.5 molL﹣1
B.0.25 molL﹣1
C.0.1 molL﹣1
D.1 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1;元素Y基态原子的3p轨道上有5个电子;元素Z的原子最外层电子数是其内层电子数的3倍;元素W基态原子的核外电子共有16种运动状态.
(1)①在元素周期表中,元素X位于区,元素Y在周期表中的位置是 . ②Z所在周期中,第一电离能最大的元素是(填元素名称).
③X+的核外电子排布式为 .
④Y和W两元素最高价氧化物对应的水化物酸性较强的是(填化学式).
(2)X与Y所形成化合物晶体的晶胞如下图所示.在1个晶胞中,X离子的数目为;该化合物的化学式为 . 
(3)①在乙醇中的溶解度:Z的氢化物(H2Z)大于H2W,其主要原因是 . ②稳定性:H2ZH2W(填“>”、“<”或“=”),其主要原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。

下列说法不正确的是
A. 电流从右侧电极经过负载后流向左侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为:2NH3-6e-=N2+6H+
D. 当有4.48LNO2(标准状况) 被处理时,转移电子为0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述或化学用语表示正确的是( )
A.S2﹣的结构示意图: ![]()
B.过氧化氢的电子式: ![]()
C.Ge原子的简化电子排布式:[Ar]4s24p2
D.氯化钠的分子式:NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种白色晶体,极微溶于水,不溶于醇类。可与水缓慢反应,易与酸反应。实验室通常用CaCl2在碱性条件下与H2O2反应制得(该反应剧烈并大量放热),装置如图所示,请回答下面的问题:
I.CaO2的制备

(1)漏斗在使用时其上口的玻璃塞应________(填“打开”或“关闭”),支管B的作用是________。
(2)将盛有浓CaCl2溶液的装置置于冰水混合物中。其原因是:使反应平稳进行、___________。
(3)加入H2O2与浓氨水的混合溶液,使反应开始。
①反应的化学方程式是_______________。
②滴加H2O2与浓氨水混合溶液之前,还应进行的操作是______。
(4)待反应结束后,经______(填操作)得CaO2粗产品。
Ⅱ.CaO2纯度的测定:将一定量的CaO2溶于稀硫酸,用标准KMnO4溶液滴定生成的H2O2(KMnO4反应后生成Mn2+),计算确定CaO2的含量。
(5)现每次称取0.4000g样品溶解后,用0.1000mol/L的KMnO4溶液滴定,所得的数据如下表所示,则样品的纯度__________。
实验序号 | ① | ② | ③ | ④ |
消耗KMnO4体积/mL | 19.98 | 20.02 | 20.20 | 20.00 |
(6)测得CaO2样品的纯度偏低,其原因可能是______(选填编号)。
A.烘烤时间不足
B.配制KMnO4标准溶液定容时俯视容量瓶刻度线
C.在洁净干燥的酸式滴定管中未润洗即装标准液
D.滴定前尖嘴部分有气泡,滴定后消失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com