
【题目】实验室以绿矾(FeSO4·7H2O)制备补血剂甘氨酸亚铁[(NH2CH2COO)2Fe] 有关物质性质如下:
甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程:
Ⅰ.配制含0.10mol FeSO4的绿矾溶液。
Ⅱ.制备FeCO3:向配制好的绿矾溶液中,缓慢加入200mL 1.1mol·L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
Ⅲ.制备(NH2CH2COO)2Fe:实验装置如下图(夹持和加热仪器已省略),将实验Ⅱ得到的沉淀和含0.20 mol甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
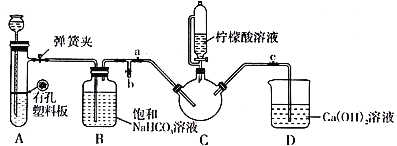
回答下列问题:
(1)实验I中:实验室配制绿矾溶液时,为防止FeSO4被氧化变质,应加入的试剂为_______(写化学式)。再滴加少量稀硫酸的作用是__________________________。
(2)实验II中:生成沉淀的离子方程式为__________________________。
(3)实验Ⅲ中:①C中盛柠檬酸溶液的仪器名称为___________________。
②装置A中所盛放的药品是___________________。(填序号)
A.Na2CO3和稀H2SO4 B.CaCO3和稀H2SO4 C.CaCO3和稀盐酸
③确认C中空气排尽的实验现象是____________________。
④加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是________________。
⑤洗涤实验Ⅲ中得到的沉淀,所选用的最佳洗涤试剂是___________________。(填序号)
A.热水 B.乙醇溶液 C.柠檬酸溶液
⑥若产品的质量为17.34g,则产率为________%。
【答案】 Fe 防止Fe2+水解 Fe2++2HCO3-=FeCO3↓+CO2↑+ H2O 滴液漏斗 C D中澄清石灰水变浑浊 防止二价铁被氧化 B 85
【解析】考查实验方案设计与评价,(1)Fe2+具有还原性,能被空气中氧气氧化,因此需要加入Fe粉,防止Fe2+被氧化;Fe2+能发生水解,加入稀硫酸的目的是抑制Fe2+的水解;(2)实验II制备的是FeCO3,所用试剂为FeSO4和NH4HCO3,利用HCO3-的电离HCO3-![]() CO32-+H+,Fe2+结合CO32-,促使平衡向正反应方向进行,H+浓度增大,H+与HCO3-反应生成CO2,因此离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;(3)①根据仪器的特点,盛放柠檬酸打的仪器是滴液漏斗;②装置A制备CO2,装置A为启普发生器的简易装置,因此盛放的药品是CaCO3和盐酸,故C正确;③空气排尽,CO2充满装置,即装置D中出现白色沉淀,或溶液变浑浊;④根据信息,柠檬酸具有还原性和强酸性,能够促进FeCO3的溶解,防止Fe2+被氧化;⑤甘氨酸亚铁易溶于水,难溶于乙醇,因此用乙醇溶液洗涤,故选项B正确;⑥根据元素守恒,FeCO3过量,甘氨酸不足,因此甘氨酸亚铁的物质的量为0.2/2mol=0.1mol,质量为20.4g,产率为17.34/20.4×100%=85%。
CO32-+H+,Fe2+结合CO32-,促使平衡向正反应方向进行,H+浓度增大,H+与HCO3-反应生成CO2,因此离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;(3)①根据仪器的特点,盛放柠檬酸打的仪器是滴液漏斗;②装置A制备CO2,装置A为启普发生器的简易装置,因此盛放的药品是CaCO3和盐酸,故C正确;③空气排尽,CO2充满装置,即装置D中出现白色沉淀,或溶液变浑浊;④根据信息,柠檬酸具有还原性和强酸性,能够促进FeCO3的溶解,防止Fe2+被氧化;⑤甘氨酸亚铁易溶于水,难溶于乙醇,因此用乙醇溶液洗涤,故选项B正确;⑥根据元素守恒,FeCO3过量,甘氨酸不足,因此甘氨酸亚铁的物质的量为0.2/2mol=0.1mol,质量为20.4g,产率为17.34/20.4×100%=85%。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】等体积,浓度均为0.1mol/L的三种溶液:①CH3COOH溶液、②HSCN溶液、③NaHCO3溶液,已知将①、②分别与③混合,实验测得产生的CO2气体体积(v)随时间(t)变化的示意图所示,下列说法正确的是( ) 
A.物质酸性的比较:CH3COOH>HSCN>H2CO3
B.反应结束后所得两溶液中,c(CH3COO﹣)>c(SCN﹣)
C.上述三种溶液中由水电离的c(OH﹣)大小:NaHCO3>CH3COOH>HSCN
D.CH3COOH溶液和NaHCO3溶液反应所得溶液中:c(CH3COO﹣)+c(CH3COOH)=0.10molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语书写正确的是
A. 苯的硝化反应的化学方程式:![]() +HO-NO2
+HO-NO2![]()
![]() +H2O
+H2O
B. 电解饱和氯化铜溶液(惰性电极)的阳极反应式:Cu2++2e-=Cu
C. 打磨过的镁条与热水反应的离子反应式:Mg+2H+=Mg2++H2↑
D. 燃煤烟气用氨水法脱硫的化学反应式:4NH3·H20+2SO2+O2=2(NH4)2SO4+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(气体体积已折算为标准状况下的体积)。下列分析正确的是

A. OE段表示的平均速率最快
B. EF段,用盐酸表示该反应的平均反应速率为0.4mol/(L·min)
C. OE、EF、FG三段中,用二氧化碳表示该反应的平均反应速率之比为2:6:7
D. G点CO2不再增加的原因可能是盐酸的浓度过低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列按电解质、非电解质、酸性氧化物、碱性氧化物的组合,正确的是( )
选项 | 电解质 | 非电解质 | 酸性氧化物 | 碱性氧化物 |
A | HCl | 液氨 | CO | K2O |
B | 氯化钠溶液 | 蔗糖 | SiO2 | CaO |
C | 熔融NaCl | 氨水 | SO2 | Al2O3 |
D | CaSO4 | 酒精 | CO2 | Na2O |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】节能减排、开发新能源目前受到国际社会的高度关注。
(1)近年我国努力开发新能源,调整能源结构。下列属于可再生能源的是_______(填字母)。
A.氢能 B.天然气 C.石油 D.生物质能
(2)工业生产中会产生SO2、H2S等有害气体,可采取多种方法进行处理。
I.生物法脱H2S的原理为:H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4![]() 2Fe2(S04)3+2H2O
2Fe2(S04)3+2H2O
①硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是_______。
②由图1和图2判断使用硫杆菌的最佳条件为_____。若反应温度过高,反应速率下降,其原因是_____。

I.双碱法去除SO2的原理是先用NaOH溶液吸收SO2,再用CaO使NaOH再生。
NaOH溶液![]() Na2SO3溶液
Na2SO3溶液
写出过程①的离子方程式:______________。
(3)人们也利用多种方法回收利用烟气用的有害气体,变废为宝。如果利用NaOH溶液、石灰和O2处理硫酸工厂尾气中的SO2使之最终转化为石膏(CaSO4·2H2O),假设硫元素不损失,每天处理1000m3(标准状况)含0.2%(体积分数)SO2的尾气,理论上可以得到多少千克石膏 (计算结果保留小数点后一位)?_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《中国诗词大会》不仅弘扬了中华传统文化,还蕴含着许多化学知识。下列诗句的有关说法错误的是
A. 王安石诗句“雷蟠电掣云滔滔,夜半载雨输亭皋”。雷雨天实现了大气中氮的固定
B. 于谦诗句“凿开混沌得乌金,藏蓄阳和意最深”。“ 乌金”指的是石油
C. 赵孟頫诗句“纷纷灿烂如星陨,霍霍喧逐似火攻”。灿烂的烟花与某些金属元素的焰色反应有关
D. 刘禹锡诗句“千淘万漉虽辛苦,吹尽黄沙始到金”。金性质稳定,存在游离态,可用物理方法获得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是探究化学过程的重要途径,有关下列各实验装置图的叙述正确的是( )

![]()
A. 图I可用于探究 NaHCO3固体的热稳定性
B. 图Ⅱ用于从氯化钠溶液中获得晶体
C. 图III中b口进气可收集Cl2、CO2等气体
D. 图Ⅳ中若X为NaOH溶液,则可完成SO2的喷泉实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把海水过滤除杂后,又提取出了氯化钠、溴、镁等化学物质。剩余的富碘卤水中,采用下面的工艺流程生产单质碘:

回答下列问题:
(1)丁溶液中的溶质为________(填化学式)。
(2)写出物质的甲化学式__________________。
(3)第⑦步的操作中提取I2的方法是___________________________ (写出操作名称)。
(4)检验生成物I2的方法是________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com