
硫酸工业中接触氧化是最重要的一个反应:2SO2(g) + O2(g)  2SO3(g) △H= -197kJ/mol。为了研究这一反应,在体积为2L的密闭容积中,投入2mol SO2,1molO2,然后控制反应温度,在反应进行至20min时加入一定的催化剂,测定并记录一定时间内容器内SO3的物质的量,得到下表:
2SO3(g) △H= -197kJ/mol。为了研究这一反应,在体积为2L的密闭容积中,投入2mol SO2,1molO2,然后控制反应温度,在反应进行至20min时加入一定的催化剂,测定并记录一定时间内容器内SO3的物质的量,得到下表:
时间/min | 10 | 20 | 30 | 40 | 50 |
N(SO3)/mol | 0.4 |
0.6 | 1.2 | 1.6 | 1.6 |
(1)反应前10 min,用O2表示该反应的反应速率v(O2)= 。
(2)该温度下,该反应的平衡常数为 。
(3)在反应进行至50min时,再向容器中充入2molSO2和1molO2,达到新平衡后,SO2的转化率将 。(填“增大”、“减小”或“不变”)
(4)保持温度不变,若在该容器中只投入2mol SO3,达到平衡时,反应吸收的热量为 kJ。
(1)0.01mol/(L·min) (2)160 (3)增大 (4)39.4
【解析】
试题解析:(1)反应前10 min,用SO3表示该反应的反应速率v(SO2)=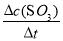 =
=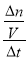 =
=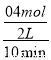 =0.02mol/(L·min),利用速率之比等于计量系数比可知,v(O2)=
=0.02mol/(L·min),利用速率之比等于计量系数比可知,v(O2)=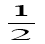 v(SO2)=0.01mol/(L·min);(2)由表中数据可知,40分钟达到平衡,则可逆反应: 2SO2(g) + O2(g)
v(SO2)=0.01mol/(L·min);(2)由表中数据可知,40分钟达到平衡,则可逆反应: 2SO2(g) + O2(g) 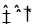 2SO3(g)
2SO3(g)
起始浓度(mol/L) : 1 0.5 0
变化浓度(mol/L) :0.8 0.4 0.8
平衡浓度(mol/L) :0.2 0.1 0.8
该反应的平衡常数K= =
=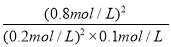 =160;(3)在反应进行至50min时,再向容器中充入2molSO2和1molO2,在体积不变的条件下,物质的量同时扩大1倍,相当于增大压强,平衡向正反应方向移动,达到新平衡后,SO2的转化率将增大;(4)保持温度不变,若在该容器中只投入2mol SO3,与上述可逆反应相比较,相当于由逆反应建立平衡,两者是等效的,达平衡时 SO3的浓度为0.8mol/L,转化的浓度=1mol/L-0.8mol/L=0.2mol/L,则SO3的转化率=
=160;(3)在反应进行至50min时,再向容器中充入2molSO2和1molO2,在体积不变的条件下,物质的量同时扩大1倍,相当于增大压强,平衡向正反应方向移动,达到新平衡后,SO2的转化率将增大;(4)保持温度不变,若在该容器中只投入2mol SO3,与上述可逆反应相比较,相当于由逆反应建立平衡,两者是等效的,达平衡时 SO3的浓度为0.8mol/L,转化的浓度=1mol/L-0.8mol/L=0.2mol/L,则SO3的转化率=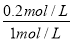 =20%,反应吸收的热量为197kJ/mol×20%=39.4KJ。
=20%,反应吸收的热量为197kJ/mol×20%=39.4KJ。
考点:化学反应速率、化学平衡


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源:2014-2015学年湖南省高三上学期第一次考试化学试卷(解析版) 题型:选择题
水溶液中能大量共存的一组离子是
A.Na+、Ca2+、Cl-、SO42- B.Fe2+、H+、SO32-、ClO-
C.Mg2+、NH4+、Cl-、SO42- D.K+、Fe3+、NO3-、SCN-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南益阳市高一上学期10月月考化学试卷(解析版) 题型:选择题
同温同压下,等质量的下列气体所占有的体积最大的是( )
A.O2 B.CH4 C.CO2 D. SO2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北鄂州市高二上第一次月考化学试卷(解析版) 题型:选择题
下列说法或表示方法正确的是
A.若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(石墨)=C(金刚石)ΔH = +1.9kJ/mol”可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH = - 57.3kJ/mol,若将含1molCH3COOH与含1mol NaOH的溶液混合,放出的热量小于57.3kJ
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表为:2H2(g)+O2(g)=2H2O(l)ΔH = —285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北鄂州市高二上第一次月考化学试卷(解析版) 题型:选择题
下列化学反应的离子方程式书写正确的是
A.氯气通入氯化亚铁溶液中:Fe2++Cl2==2Cl-+Fe3+
B.氯气与水反应:Cl2 + H2O==Cl-+ ClO- + 2H+
C.铜与稀硝酸反应:3Cu + 8H+ + 2NO ==3Cu2+ + 2NO↑ + 4H2O
==3Cu2+ + 2NO↑ + 4H2O
D.三氯化铝中加入过量的氨水:Al3++4 NH3·H2O = AlO2— +4NH4+ + 2 H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省高二上学期期中考试试化学试卷(解析版) 题型:选择题
在容积固定的密闭容器中存在如下反应:A(g)+3B(g) 2C(g) △H<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图,下列判断一定错误的是
2C(g) △H<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图,下列判断一定错误的是
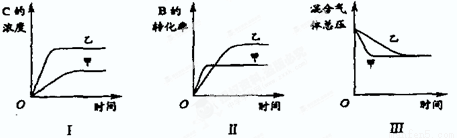
A.图I研究的是压强对反应的影响,且乙的压强较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省高二上学期期中考试试化学试卷(解析版) 题型:选择题
对已经达到平衡的反应 2X(g) + Y(g)  2Z(g) ΔH<0 ,下列说法正确的是
2Z(g) ΔH<0 ,下列说法正确的是
A.缩小容器体积,正、逆反应速率都增大,平衡向逆反应方向移动
B.升高反应温度,该反应的平衡常数增大
C.加入催化剂,可以降低反应所需的活化能,但不改变反应的ΔH
D.改变条件使平衡正向移动,反应物的转化率一定都增大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省高一上学期期中化学试卷(解析版) 题型:选择题
将0.2mol·L-1Ba(OH)2溶液与0.05mol·L-1NaHSO4溶液等体积混合后,下列几种离子浓度大小顺序正确的是
A.c(Ba2+)>c(OH-)>c(Na+)>c(SO42-)
B.c(Na+)>c(OH-)>c(Ba2+)>c(SO42-)
C.c(Na+)>c(Ba2+)>c(OH-)>c(SO42-)
D.c(OH-)>c(Ba2+)>c(Na+)>c(SO42-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省高二上学期10月月考化学试卷(解析版) 题型:选择题
2005年2月18日,英国食品标准局向英国民众发出警告,公布了359种食品中含有可能致癌的“苏丹红一号”,一时间“苏丹红一号”成为媒体关注的焦点。“苏丹红一号”的结构简式:
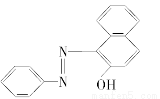
下列关于苏丹红一号的有关叙述正确的是
A.苏丹红一号的分子式C18H12N2O
B.苏丹红一号的相对分子质量是248 g·mol-1
C.苏丹红一号属于烃
D.苏丹红一号能发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com