
【题目】一定条件下发生反应:m A(g)+n B(g) ![]() p C(g)+q D(g) ΔH,反应物起始浓度相同,现在不同的温度T1和T2下反应分别达到平衡状态,B转化率与温度的关系如图所示,则下列叙述正确的是
p C(g)+q D(g) ΔH,反应物起始浓度相同,现在不同的温度T1和T2下反应分别达到平衡状态,B转化率与温度的关系如图所示,则下列叙述正确的是

A. 平衡时D的体积分数:状态Ⅱ大于状态Ⅰ B. T1>T2
C. 平衡时正反应速率:状态Ⅱ比状态Ⅰ大 D. ΔH<0
科目:高中化学 来源: 题型:
【题目】常温下,体积均为1L的HA、HB的两种一元酸溶液,分别向其中加水稀释至体积V,pH随lgV的变化关系如图所示。下列说法正确的是
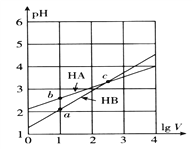
A. HA是弱酸,HB是强酸
B. 相同温度、相同浓度的NaA、NaB溶液的pH,后者大
C. c点处,分别加入足量的锌粒,HA中产生氢气多
D. a、b、c三点,由水电离出来的c(H+)·c(OH-)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要制备纯净的氯化钾。现含有少量K2SO4的氯化钾样品,按照如图所示的实验方案进行提纯。

(1)检验加入BaCl2溶液后![]() 是否沉淀完全的操作为____________________________。
是否沉淀完全的操作为____________________________。
(2)若用硝酸钡来代替氯化钡,请判断是否可行,并说明理由:_____________________。
(3)某同学认为该实验方案中加适量氯化钡溶液不容易控制,应加入过量氯化钡溶液,他的思路如下:

请写出①②③④⑤溶质或沉淀的化学式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料生产铝和氮化铝的一种工艺流程如下[已知:SiO2在“碱溶”时转化为铝硅酸钠(NaAlSiO4·nH2O)沉淀]。

(1)操作I、Ⅱ的名称为____________。
(2)用氧化物的形式表示铝硅酸钠的化学式_____________。
(3)杂质Fe2O3最后存在于___________中。
(4)工业制备Al的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Zn(s)+![]() O2(g)=ZnO(s)ΔH=-348.3kJ·mol-1
O2(g)=ZnO(s)ΔH=-348.3kJ·mol-1
②2Ag(s)+![]() O2(g)=Ag2O(s)ΔH=-31.0kJ·mol-1
O2(g)=Ag2O(s)ΔH=-31.0kJ·mol-1
则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为
A. 2Zn(s)+2Ag2O(s)===2ZnO(s)+4Ag(s)ΔH=-634.6 kJ·mol-1
B. Zn+Ag2O===ZnO+2Ag ΔH=+317.3kJ·mol-1
C. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=-317.3kJ
D. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=+317.3kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】区别棉花和羊毛的最简单的方法是( )
A.加入稀硫酸后加热使之水解,检验水解产物能否发生银镜反应
B.浸入浓硝酸中,观察其颜色是否变黄色
C.在火中灼烧,闻其是否有烧焦羽毛的气味
D.通过化学方法测其组成中是否含有硫、氮等元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:aA(g)+bB(g)![]() cC(g)+dD(g)
cC(g)+dD(g)![]() H,学习小组针对反应特点与对应的图象展开了讨论,其中不正确的是
H,学习小组针对反应特点与对应的图象展开了讨论,其中不正确的是

A. 图①中,若p1>p2,则a+b>c+d
B. 图②中,若T2>T1,则![]() H<0且a+b=c+d
H<0且a+b=c+d
C. 图③中,t1时刻改变的条件一定是使用了催化剂
D. 图④中,若![]() H<0,则纵坐标不可能表示反应物的转化率
H<0,则纵坐标不可能表示反应物的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下CH3COOH的电离常数为1.7×10-5,该温度下用0.1mol·L-1的醋酸溶液滴定10.00mL等物质的量浓度的碱ROH,滴定过程中加入醋酸的体积(V)与溶液中![]() 的关系如图所示。下列说法中正确的是
的关系如图所示。下列说法中正确的是
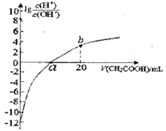
A. b点溶液显碱性
B. a>10.00
C. ROH的电离方程式为ROH![]() R++OH-
R++OH-
D. 25℃时,1mol·L-1的醋酸溶液中CH3COO-的浓度约为4.12×10-2mol·L-1(已知![]() =4.12)
=4.12)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com