
����Ŀ����Na2CO3��NaAlO2�Ļ����Һ����μ���150mL 1molL��1 HCl��Һ�������Һ�е�ij�����������ʵ����ı仯��ͼ��ʾ��������˵������ȷ���ǣ� �� 
A.a���߱�ʾ�����ӷ���ʽΪ��AlO2��+H++H2O�TAl��OH��3��
B.b��c���߱�ʾ�����ӷ�Ӧ����ͬ��
C.M��ʱ����Һ�г���������Ϊ3.9g
D.ԭ�����Һ�е�CO32����AlO2�������ʵ���֮��Ϊ1��2
���𰸡�D
���������⣺Na2CO3��NaAlO2�Ļ����Һ�м���HCl��Һ���ȷ�����ӦAlO2��+H++H2O�TAl��OH��3����a�߱�ʾAlO2�����٣��ڶ��Σ�AlO2����Ӧ��ϣ�������ӦCO32��+H+�THCO3�� �� b�߱�ʾCO32�����٣�c�߱�ʾHCO3�������ӣ������Σ�CO32����Ӧ��ϣ�������ӦHCO3��+H+�TCO2��+H2O��d�߱�ʾHCO3�����٣��˽�Al��OH��3�����뷴Ӧ�� A��Na2CO3 �� NaAlO2�Ļ����Һ�м���HCl��Һ���ȷ�����Ӧ��AlO2��+H++H2O�TAl��OH��3������A��ȷ��
B���ڶ��Σ�AlO2����Ӧ��ϣ�������Ӧ��CO32��+H+�THCO3�� �� b�߱�ʾCO32�����٣�c�߱�ʾHCO3�������ӣ�����b��c���߱�ʾ�����ӷ�Ӧ����ͬ�ģ���B��ȷ��
C������50mLʱNaAlO2����Ԫ��ȫ��ת��Ϊ����������������50mL����֮��CO32����Ӧ�����������������ܽ⣬��M�����������������50mLʱ������������ͬ����NaAlO2+HCl+H2O=NaCl+Al��OH��3��֪��n��Al��OH��3��=n��NaAlO2��=n��HCl��0.05mol��m[Al��OH��3]=0.05mol��78g/mol=3.9g����C��ȷ��
D����һ���ڶ��������ĵ�������������50ml���������ĵ��Ȼ�������ʵ�����ȣ����ݵ�һ�Ρ��ڶ��η�����ӦAlO2��+H++H2O�TAl��OH��3����CO32��+H+�THCO3�� �� ��֪CO32����AlO2�������ʵ���֮��Ϊ1��1�������������ʶ���ǿ�������ζ���ˮ�⣬ˮ��̶Ȳ�ͬ�������ж���Һ��CO32����AlO2�������ʵ���֮�ȣ���D����
��ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ������һ���ܴ���������� ( )
A��0.1mol/LNaOH��Һ�У�Na+��K+��Ca2+ ��HCO3-
B����ɫ��Һ�У�H+��Fe2����Al3+��NO3-
C������������������Һ�У�NH4+��Cl-��Mg2+��SO42-
D��pH��7����Һ�У�Na+��K+��AlO2-��SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ϩ�����ǣ� ��
A. CH3CH2CH3 B. CH2=CHCH3
C. CH2=CHCH2Cl D. CH2=CHCOOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������м���ڹ���������ټ����������ʣ��������������ɵ���(����)
A. ϡ���� B. ������� C. �Ȼ�п D. �Ȼ�ͭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ���������ַ�Ӧԭ����
��CH3OH(g)+H2O(g)=CO2(g)+3H2(g)�� ��H= +49.0 kJ��mol��1
��CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g)����H= -192.9 kJ��mol��1
����˵����ȷ����
A. CH3OH��ȼ����Ϊ192��9 kJ��mol��1
B. ��Ӧ���е������仯��ͼ��ʾ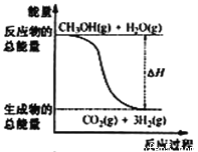
C. CH3OHת���H2�Ĺ���һ��Ҫ��������
D. ���ݢ���֪��Ӧ�� CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)����H>��192��9kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ӹ���ʱ���õĺ�ҩΪ�Ȼ�泥����������������Ӵ������⣮�����ķ�Ӧ��ϵ�й����������ʣ�NH4Cl��FeCl3��N2��Fe2O3��Fe��X��
��1���������⣬���жϳ�X����д��ѧʽ����
��2��д������ƽ�÷�Ӧ�Ļ�ѧ����ʽ����
��3��������ԭ��Ӧ�������� �� ��Ӧ��2mol�������������ʧȥ���õ�����mol���ӣ�
��4����Ӧ�б�����������5.6L����״����������ʱ������ԭ�����ʵ�����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����þ�����Ļ���ﹲ0.2mol������200mL4molL��1��������Һ�У�Ȼ���ٵμ�2molL��1��NaOH��Һ����ش��������⣺�� 
��1�����ڵμ�NaOH��Һ�Ĺ����У���������m�����NaOH��Һ�����V�仯�����ͼ��ʾ����V1=160mLʱ���������ĩ��n��Mg��=mol��
��2��0��V1�η����ķ�Ӧ�����ӷ���ʽΪ��
��3�����ڵμ�NaOH��Һ�Ĺ����У���ʹMg2+��Al3+�պó�����ȫ�������NaOH��Һ�����V��NaOH��=mL��
��4���Լ���V2��ֵ��V2=mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D��E��ԭ���������������ǰ������Ԫ�أ�A�Ƕ������������������������ķǽ���Ԫ�أ�BԪ���γɵĻ�����������ࣻD����������������Ӳ���֮��Ϊ3��1��E�ǵ�������Ԫ�أ������ֻ��һ�����ӣ����������Ӿ���������ش��������⣨��Ԫ�ط��Ż�ѧʽ��ʾ����
��1��E�����ڱ���λ��__________����E+�ĵ����Ų�ʽΪ__________________________��
��2��DԪ��ԭ�ӵļ۲�����Ų�ͼΪ___________________��A2D2�ĵ���ʽΪ____________��������Dԭ���ӻ�����Ϊ______________��
��3��Ԫ��B��C��D�Ļ�̬ԭ�ӵĵ縺���ɴ�С��˳��Ϊ___________________________��A�ֱ���B��C��D���γɵ���10�Ļ�������ǵķе��ɸߵ��͵�˳����__________��д����ʽ����
��4��C2A4�ڼ�����Һ���ܹ���ED��ԭΪE2D����֪��1mol C2A4��ȫ�μӷ�Ӧʱת����4 mol���ӣ���÷�Ӧ�Ļ�ѧ����ʽ�ɱ�ʾΪ��___________________��
��5����֪EA����ṹ��Ԫ��ͼ��ʾ��Aԭ������Խ��ߵ�1/4�������û�������ܶ�Ϊ��g��cm-3�������ӵ�������ֵΪNA����þ�����Eԭ����Aԭ��֮�����̾���Ϊ_______cm���ú�����NA��ʽ�ӱ�ʾ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£����ڷ�ӦN2(g)��3H2(g��![]() 2NH3 (g����H����92.4kJ/mol��N2��ƽ��ת������(N2)����ϵ��ѹǿ��P���Ĺ�ϵ����ͼ��ʾ������˵����ȷ���ǣ�
2NH3 (g����H����92.4kJ/mol��N2��ƽ��ת������(N2)����ϵ��ѹǿ��P���Ĺ�ϵ����ͼ��ʾ������˵����ȷ���ǣ�

A. ��1.0mol������3.0mol����������1L�ܱ������з�����Ӧ���ų�������Ϊ92.4kJ
B. ������Ӧ�ڴﵽƽ�������ѹǿ��H2 ��ת�������
C. ƽ��״̬��A�䵽Bʱ��ƽ�ⳣ��K(A�� �� K(B��
D. �����¶ȣ�ƽ�����淴Ӧ�����ƶ���˵���淴Ӧ������������Ӧ���ʼ�С
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com