
【题目】将镁、铝的混合物共0.2mol,溶于200mL4molL﹣1的盐酸溶液中,然后再滴加2molL﹣1的NaOH溶液.请回答下列问题:, 
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化情况如图所示.当V1=160mL时,则金属粉末中n(Mg)=mol;
(2)0~V1段发生的反应的离子方程式为;
(3)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=mL;
(4)试计算V2的值:V2=mL.
【答案】
(1)0.12
(2)H++OH﹣=H2O
(3)400
(4)440
【解析】解:(1)当V1=160mL时,此时,溶液是MgCl2、AlCl3和NaCl的混合液, 由Na+离子守恒可知,n(NaCl)=n(Na+)=n(NaOH)=0.16L×2mol/L=0.32mol,200mL 4molL﹣1的盐酸溶液中含有氯化氢的物质的量为:4mol/L×0.2L=0.8mol,设混合物中含有MgCl2xmol、AlCl3为ymol,则:根据Mg原子、Al原子守恒有:x+y=0.2,根据Cl﹣离子守恒有:2x+3y=0.8﹣0.32=0.48,联立方程解得:x=0.12、y=0.08,所以金属粉末中:n(Mg)=0.12mol、n(Al)=y=0.08mol,所以答案是:0.12;(2)0~V1段,滴入氢氧化钠溶液后没有生成沉淀,说明盐酸过量,滴入的氢氧化钠与氯化氢反应生成氯化钠和水,反应的离子方程式为:H++OH﹣=H2O,所以答案是:H++OH﹣=H2O;(3)当溶液中Mg2+、Al3+恰好沉淀完全时,此时,溶液是NaCl溶液,根据Cl﹣离子和Na+离子守恒有:n(Na+)=n(NaCl)=(HCl)=4mol/L×0.2L=0.8mol,所以需要加入氢氧化钠溶液体积为:V(NaOH)= ![]() =0.4L=400mL,所以答案是:400;(4)图象虚线对应数据为Mg2+、Al3+恰好沉淀完全消耗氢氧化钠溶液体积,根据(1)可知氢氧化铝的物质的量为0.08mol,根据反应Al(OH)3 +NaOH=NaAlO2+2H2O可知溶解0.08mol氢氧化铝需要消耗0.08molNaOH,消耗氢氧化钠溶液体积为:
=0.4L=400mL,所以答案是:400;(4)图象虚线对应数据为Mg2+、Al3+恰好沉淀完全消耗氢氧化钠溶液体积,根据(1)可知氢氧化铝的物质的量为0.08mol,根据反应Al(OH)3 +NaOH=NaAlO2+2H2O可知溶解0.08mol氢氧化铝需要消耗0.08molNaOH,消耗氢氧化钠溶液体积为: ![]() =0.04L=40mL,所以V2=400mL+40mL=440mL,所以答案是:440.
=0.04L=40mL,所以V2=400mL+40mL=440mL,所以答案是:440.


科目:高中化学 来源: 题型:
【题目】下列对于硝酸的认识,不正确的是
A. 浓硝酸和稀硝酸都具有氧化性
B. 铜与硝酸的反应属于置换反应
C. 浓硝酸在常温下见光或受热会分解
D. 常温下可用铁或铝制品盛装浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.3g纯净的金属钠在干燥的空气中被氧化后得到3.5g固体,由此可判断其氧化产物是
A. 只有Na2O B. 只有Na2O2 C. Na2O和Na2O2 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1molL﹣1 HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是( ) 
A.a曲线表示的离子方程式为:AlO2﹣+H++H2O═Al(OH)3↓
B.b和c曲线表示的离子反应是相同的
C.M点时,溶液中沉淀的质量为3.9g
D.原混合溶液中的CO32﹣与AlO2﹣的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B两种烃,它们含碳质量分数相同,下列关于A和B的叙述正确的是( )
A.A和B一定是同分异构体
B.A和B不可能是同系物
C.A和B最简式一定相同
D.A和B的化学性质相似
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验未知溶液中是否含有SO ![]() ,下列操作中最合理的是( )
,下列操作中最合理的是( )
A.加入硝酸酸化的硝酸钡溶液
B.先加硝酸酸化,再加入硝酸钡溶液
C.加盐酸酸化了的BaCl2溶液
D.先加盐酸酸化,再加入BaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。
请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
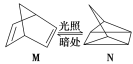 ΔH=+88.6 kJ·mol-1
ΔH=+88.6 kJ·mol-1
则M、N相比,较稳定的是 。
(2)已知CH3OH(l)的燃烧热为238.6 kJ·mol-1,CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a 238.6(填“>”、“<”或“=”)。
O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a 238.6(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式: 。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com