


 2NH3(g)
2NH3(g) 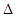 H= -93.36 kJ/mol (1分)
H= -93.36 kJ/mol (1分) NH3·H2O + H+ SO32-+H2O
NH3·H2O + H+ SO32-+H2O HSO3-+ OH-,SO32-水解程度大于NH4+的水解程度使溶液中c(OH-) > c(H+),溶液呈碱性。(1分)
HSO3-+ OH-,SO32-水解程度大于NH4+的水解程度使溶液中c(OH-) > c(H+),溶液呈碱性。(1分) 2NH3(g)
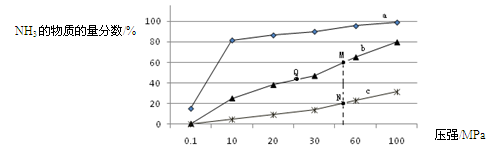
2NH3(g)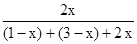 =60%,H2转化率75%。
=60%,H2转化率75%。 与S的个数比为3:2,故是1:1的(NH4)2SO3和NH4HSO3。
与S的个数比为3:2,故是1:1的(NH4)2SO3和NH4HSO3。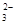 水解的缘故。
水解的缘故。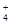 为盐直接电离的离子,SO
为盐直接电离的离子,SO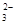 是HSO
是HSO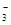 电离的离子,即c(NH4+)> c(SO32-);
电离的离子,即c(NH4+)> c(SO32-);

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源:不详 题型:单选题
 2Fe2++I2设计成下图所示的原电池。下列判断不正确的是
2Fe2++I2设计成下图所示的原电池。下列判断不正确的是

A.为证明反应的发生,可取甲中溶液加入酸性高锰酸钾溶液 |
B.反应开始时,甲中石墨电极上Fe3+被还原,乙中石墨电极上发生氧化反应 |
C.电流计读数为零时,在甲中加入FeCl2固体后,甲中石墨电极为负极 |
| D.此反应正反应方向若为放热反应,电流计读数为零时,降低温度后,乙中石墨电极为负极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
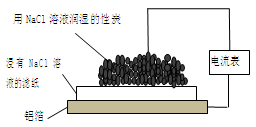
| A.该装置能将电能转化为化学能 |
| B.活性炭为正极,其电极反应式为: 2H++2e-=H2↑ |
| C.电子从铝箔流出,经电流表、活性炭、滤纸回到铝箔 |
| D.装置内总反应方程式为:4Al+3O2 +6H2O = 4Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.当电池负极消耗mg气体时,电解池阳极同时有mg气体生成 |
| B.电池负极反应式为:O2 + 2H2O + 4e—= 4OH— |
| C.电解后c(Na2CO3)不变,且溶液中有晶体析出 |
| D.电池中c(KOH)不变;电解池中溶液pH变大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.若X为碳棒,开关K置于M处,则溶液中的H+移向Fe极 |
| B.若X为碳棒,开关K置于N处,转移0.2mole一时析出0.lmolO2 |
| C.若X为铜棒,开关K置于M或N处,均可减缓铁的腐蚀 |
| D.若X为锌棒,开关K置于M或N处,锌电极上反应均为Zn-2e一=Zn2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.电极Ⅰ上发生还原反应,作原电池的负极 |
| B.电极Ⅱ的电极反应式为:Cu2++2e-=Cu |
| C.该原电池的总反应为:2Fe3++Cu=Cu2++2Fe2+ |
| D.盐桥中装有含氯化钾的琼脂,其作用是传递电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.镁作Y电极 |
| B.电池工作时,Na+向负极移动 |
| C.废液的pH大于NaClO溶液的pH |
| D.X电极上发生的反应为ClO-+2H2O-4e-===ClO3-+4H+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
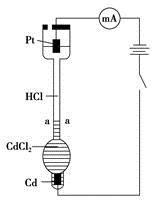
| A.通电后,可观察到清晰界面缓缓向上移动的原因是Cd2+向Pt电极迁移的结果 |
| B.装置中Pt电极附近的pH增大 |
| C.一定时间内,如果通过HCl溶液某一界面的总电量为5.0 C,测得H+所迁移的电量为4.1 C,说明该HCl溶液中H+的迁移速率约是Cl-的4.6倍 |
| D.如果电源正负极反接,则下端产生大量Cl2,使界面不再清晰,实验失败 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com