
【题目】化学与生活密切相关,下列有关说法错误的是( )
A.用灼烧的方法可以区分蚕丝和人造纤维
B.食用油反复加热会产生稠环芳香烃等有害物质
C.加热能杀死流感病毒是因为蛋白质受热变性
D.医用消毒酒精中乙醇的浓度为95%
科目:高中化学 来源: 题型:
【题目】草酸钴可用于指示剂和催化剂的制备.用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取COC2O42H2O工艺流程如下:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是 .
(2)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀.试用离子方程式和必要的文字简述其原理:_________
(3)萃取剂对金属离子的萃取率与pH的关系如右图1.萃取剂的作用是 ;其使用的适宜pH范围是 .
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(4)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10﹣11、Ksp(CaF2)=1.05×10﹣10,当加入过量NaF后,所得滤液![]() = .
= .
(5)已知:NH3H2O![]() NH4++OH﹣ Kb=1.8×10﹣5;
NH4++OH﹣ Kb=1.8×10﹣5;
H2C2O4![]() H++HC2O4﹣ Ka1=5.4×10﹣2;
H++HC2O4﹣ Ka1=5.4×10﹣2;
HC2O4﹣![]() H+C2O42﹣ Ka2=5.4×10﹣5
H+C2O42﹣ Ka2=5.4×10﹣5
则该流程中所用(NH4)2C2O4溶液的pH 7(填“>”或“<”或“=”)
(6)CoC2O42H2O热分解质量变化过程如图2所示(其中600℃以前是隔绝空气加热,600℃以后是在空气中加热);A、B、C均为纯净物;C点所示产物的化学式是_____________________


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中,全部属于组成细胞的大量元素的是( )
A. P、N、Mn、K B. N、S、Zn、P
C. Fe、S、P、N D. Ca、N、P、K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.pH=1的溶液中:Na+、K+、MnO![]() 、CO
、CO![]()
B.c(H+)=1×10-13 mol·L-1的溶液中:Mg2+、Cu2+、SO![]() 、NO
、NO![]()
C.0.1 mol·L-1 NH4HCO3溶液中:K+、Na+、NO![]() 、Cl-
、Cl-
D.0.1 mol·L-1 FeCl3溶液中:Fe2+、NH![]() 、SCN-、SO
、SCN-、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,反应①为常温下的反应,A、C、D中均含有氯元素,且A中氯元素的化合价介于C和D中氯元素的化合价之间,E在常温下为无色无味的液体,F是淡黄色固体,G为常见的无色气体。请回答下列问题:
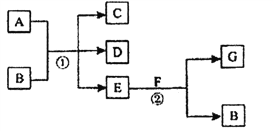
(1)A、G的化学式分别为_______________、________________。
(2)写出A与Fe反应的化学方程式___________________ 。
(3)写出反应②的化学方程式______________________。
(4)己知A是一种重要的化工原料,在工农业生产和生活中有着重要的应用。请根据所学知识回答下列问题。
①将A通入紫色石蕊试液中,观察到的现象是________________;请写出A与水反应的化学方程
式 。
②A与石灰乳反应制得的漂白粉的有效成分是_________(填化学式);该物质在空气中失效的原因______(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜和镁的合金2.14g完全溶于一定浓度的硝酸,若反应中硝酸被还原为NO2、NO、N2O三种气体而且在标准状况下它们的体积均为0.224 L。在反应后的溶液中,加入足量的氢氧化钠溶液,生成的沉淀经过滤、洗涤、低温干燥后称量,质量为( )
A.4.18g B.3.12g C.4.68g D.5.08g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向体积恒定为2L的密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+ N(g) ![]() E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2molL-1.下列说法正确的是( )
E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2molL-1.下列说法正确的是( )
A.4min时,M的转化率为80%
B.4min时,用M表示的反应速率为0.8molL-1min-1
C.4min后,向容器中充入不参与反应的稀有气体,M的物质的量减小
D.2min时,M的物质的量浓度为0.6molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种试验某气体化学性质的实验装置,图中B为开关,如先关闭B,在A处通入干燥氯气,C中红色布条颜色褪去;当打开B时,C处红色布条颜色不退去。则D瓶中盛有的溶液是
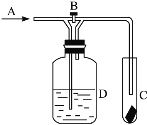
A.浓硫酸 B.饱和NaCl溶液
C.浓NaOH溶液 D.CCl4有机溶剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德·埃特尔。他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论。在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法正确的是
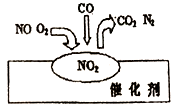
A.NO2是该过程的最终产物
B.NO 和O2必须在催化剂表面才能反应
C.汽车尾气的主要污染成分是CO2和NO
D.该催化转化的总反应方程式为:2NO+O2+4CO![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com