
【题目】近日,各地媒体纷纷报道了有“火锅红”、“火锅飘香剂”、“辣椒精”等造就的“化学火锅”的新闻,食品添加剂的使用引起了人们的注意,亟待规范。
乙偶姻是一种应用较广泛的香料.乙偶姻(相对分子质量为88)中只含有C、H、O三种元素,其原子个数比为2:4:1,乙偶姻中含有碳氧双键.与乙偶姻有关的反应如下:
已知:HO﹣RCH﹣CHR’﹣OH![]() RCHO+R’CHO
RCHO+R’CHO
(1)乙偶姻的分子式为__,G的结构简式为__;
(2)反应①、②的反应类型为:①__、②__;
(3)D→E反应的化学方程式为________________;
B→C反应的化学方程式为___________________;
(4)X是乙偶姻的同分异构体,属于酯类,写出2种X可能的结构简式:______________。
【答案】C4H8O2 CH3CH2OH 消去反应 加聚反应 CH3CH(OH)CH(OH)CH3+2![]()
![]()
![]() +2H2O n
+2H2O n![]()
![]()
![]() HCOOCH2CH2CH3 CH3COOCH2CH3
HCOOCH2CH2CH3 CH3COOCH2CH3
【解析】
乙偶姻(相对分子质量为88)中只含有C、H、O三种元素,其原子个数比为2:4:1,最简式为C2H4O,令乙偶姻的组成为(C2H4O)n,则(24+4+16)n=88,解得n=2,故乙偶姻分子式为C4H8O2,乙偶姻中含有碳氧双键,能被氧化为A,A的相对分子质量比乙偶姻小2,故乙偶姻中还含有羟基﹣OH,乙偶姻能与氢气发生加成反应反应生成D,D在HIO4作用下反应生成F,结合题目中信息HO﹣RCH﹣CHR’﹣OH![]() RCHO+R’CHO可知,D中含有2个相邻的﹣OH,且为对称结构,故D为CH3CH(OH)CH(OH)CH3,F为CH3CHO,乙偶姻结构为
RCHO+R’CHO可知,D中含有2个相邻的﹣OH,且为对称结构,故D为CH3CH(OH)CH(OH)CH3,F为CH3CHO,乙偶姻结构为![]() ,A的结构为
,A的结构为![]() ,乙偶姻在浓硫酸、加热条件下发生消去反应生成B,B为
,乙偶姻在浓硫酸、加热条件下发生消去反应生成B,B为![]() ,C是链状高分子化合物,B发生加聚反应生成C,C为
,C是链状高分子化合物,B发生加聚反应生成C,C为![]() ,F与氢气发生加成反应生成G,G为CH3CH2OH,D与足量的苯甲酸发生酯化反应生成E,E为
,F与氢气发生加成反应生成G,G为CH3CH2OH,D与足量的苯甲酸发生酯化反应生成E,E为![]() ;
;
乙偶姻(相对分子质量为88)中只含有C、H、O三种元素,其原子个数比为2:4:1,最简式为C2H4O,令乙偶姻的组成为(C2H4O)n,则(24+4+16)n=88,解得n=2,故乙偶姻分子式为C4H8O2,乙偶姻中含有碳氧双键,能被氧化为A,A的相对分子质量比乙偶姻小2,故乙偶姻中还含有羟基﹣OH,乙偶姻能与氢气发生加成反应反应生成D,D在HIO4作用下反应生成F,结合题目中信息HO﹣RCH﹣CHR’﹣OH![]() RCHO+R’CHO可知,D中含有2个相邻的﹣OH,且为对称结构,故D为CH3CH(OH)CH(OH)CH3,F为CH3CHO,乙偶姻结构为
RCHO+R’CHO可知,D中含有2个相邻的﹣OH,且为对称结构,故D为CH3CH(OH)CH(OH)CH3,F为CH3CHO,乙偶姻结构为![]() ,A的结构为
,A的结构为![]() ,乙偶姻在浓硫酸、加热条件下发生消去反应生成B,B为
,乙偶姻在浓硫酸、加热条件下发生消去反应生成B,B为![]() ,C是链状高分子化合物,B发生加聚反应生成C,C为
,C是链状高分子化合物,B发生加聚反应生成C,C为![]() ,F与氢气发生加成反应生成G,G为CH3CH2OH,D与足量的苯甲酸发生酯化反应生成E,E为
,F与氢气发生加成反应生成G,G为CH3CH2OH,D与足量的苯甲酸发生酯化反应生成E,E为![]() ;
;
(1)由上述分析可知,乙偶姻的分子式为C4H8O2,G的结构简式为CH3CH2OH;
(2)反应①是乙偶姻在浓硫酸、加热条件下发生消去反应生成![]() ,反应②是
,反应②是![]() 发生加聚反应生成
发生加聚反应生成![]() ;
;
(3)D→E是CH3CH(OH)CH(OH)CH3与足量的苯甲酸发生酯化反应生成![]() ,反应方程式为CH3CH(OH)CH(OH)CH3+2
,反应方程式为CH3CH(OH)CH(OH)CH3+2![]()
![]()
![]() +2H2O,B→C是
+2H2O,B→C是![]() 发生加聚反应生成
发生加聚反应生成![]() ,反应的化学方程式为n
,反应的化学方程式为n![]()
![]()
![]() ;
;
(4)X是乙偶姻的同分异构体,属于酯类,X可能的结构简式:HCOOCH2CH2CH3、HCOOC(CH3)2、CH3COOCH2CH3、CH3CH2COOCH3,(任意两种)。


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断正确的是
A.生成40.0L N2(标准状况)B.有0.250mol KNO3被氧化
C.转移电子的物质的量为1.25molD.被氧化的N原子的物质的量为4.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图进行实验,将a溶液逐渐加入盛b溶液的试管中,写出试管中观察到的现象及对应的离子方程式。
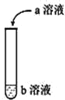
a | b | 试管中现象 | 离子方程式 |
Na2CO3 | 稀盐酸 | ________________ | _________ |
稀盐酸 | Na2CO3 | ______________ | _______________ |
(2)工业上利用NaIO3和NaHSO3反应来制取单质I2。配平下列化学方程式并用单线桥法表示电子转移的方向和数目:
_____NaIO3+_____NaHSO3=_____I2+_____Na2SO4+_____H2SO4+_____H2O
(3)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取![]() 。写出该反应的离子方程式,并用双线桥法表示电子转移的方向和数目_____________________。
。写出该反应的离子方程式,并用双线桥法表示电子转移的方向和数目_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)已知室温下CO的燃烧热为283kJ/mo1,则CO的燃烧热的热化学方程式为____。
(2)工业上利用CO和H2合成清洁能源CH3OH,其反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH=-116kJ/mo1
CH3OH(g) ΔH=-116kJ/mo1
如图表示CO的平衡转化率(α)随温度和压强变化的示意图。
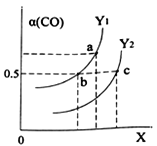
X表示的是_____,Y1___Y2(填“<”、“=”、“>”)。
(3)合成甲醇的反应原理为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),在1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),在1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
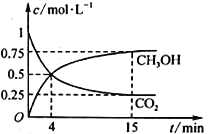
①反应进行到4min时,v(正)___v(逆)(填“>”“<”或“=”)。0~4min,CO2的平均反应速率v(CO2)=_____mol·L1·min1。
②该温度下平衡常数为____。
③下列能说明该反应已达到平衡状态的是____。
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1∶3∶1∶1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸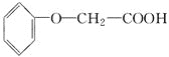 发生酯化反应的产物。
发生酯化反应的产物。
(1)甲一定含有的官能团的名称是________。
(2)5.8 g甲完全燃烧可产生0.3 mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是____________________________。
(3)菠萝酯的结构简式是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g),反应进行到10 s末,测得A的物质的量为1.8 mol, B的物质的量为0.6 mol,C的物质的量为0.8 mol,则:
2C(g)+2D(g),反应进行到10 s末,测得A的物质的量为1.8 mol, B的物质的量为0.6 mol,C的物质的量为0.8 mol,则:
(1)用C表示10 s内反应的平均反应速率为__________;
(2)反应前A的物质的量浓度是__________;
(3)10 s末,生成物D的浓度为________;
(4)若改变下列条件,生成D的速率如何变化(用“增大”“减小”或“不变”填空)。
编号 | 改变的条件 | 生成D的速率 |
① | 降低温度 | _______ |
② | 增大A的浓度 | _______ |
③ | 使用催化剂 | _______ |
④ | 恒容下充入Ne(不参与体系反应) | _______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含苯酚的工业废水的处理流程如图所示。

(1)①流程图设备Ⅰ中进行的是操作________(填写操作名称)。实验室里这一步操作可以用_______(填仪器名称)进行。
②由设备Ⅱ进入设备Ⅲ的物质A是______________(填化学式,下同)。由设备Ⅲ进入设备Ⅳ的物质B是___________。
③在设备Ⅲ中发生反应的化学方程式为_____________________。
④在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和______。通过 _________________(填操作名称)操作,可以使产物相互分离。
⑤图中,能循环使用的物质是_______、_____________C6H6和CaO。
(2)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是____________。
从废水中回收苯酚的方法是①用有机溶剂萃取废液中的苯酚;②加入某种药品的水溶液使苯酚与有机溶剂脱离;③加入某物质又析出苯酚。试写出②、③两步的反应方程式:_________________________。
(3)为测定废水中苯酚的含量,取此废水100 mL,向其中加入浓溴水至不再产生沉淀为止,得到沉淀0.331 g,求此废水中苯酚的含量____________(mg·L-1)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com