
����Ŀ���ش��������⣺
��1����֪������CO��ȼ����Ϊ283kJ/mo1����CO��ȼ���ȵ��Ȼ�ѧ����ʽΪ____��
��2����ҵ������CO��H2�ϳ������ԴCH3OH���䷴ӦΪ��CO(g)+2H2(g)![]() CH3OH(g) ��H=-116kJ/mo1
CH3OH(g) ��H=-116kJ/mo1
��ͼ��ʾCO��ƽ��ת����(��)���¶Ⱥ�ѹǿ�仯��ʾ��ͼ��
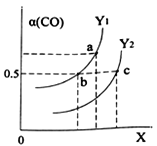
X��ʾ����_____��Y1___Y2(����<������=������>��)��
��3���ϳɼ״��ķ�Ӧԭ��Ϊ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)����1L���ܱ������У�����1mol CO2��3mol H2����500���·�����Ӧ�����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
CH3OH(g)+H2O(g)����1L���ܱ������У�����1mol CO2��3mol H2����500���·�����Ӧ�����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
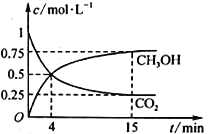
�ٷ�Ӧ���е�4minʱ��v(��)___v(��)(����>����<������=��)��0~4min��CO2��ƽ����Ӧ����v(CO2)=_____mol��L1��min1��
�ڸ��¶���ƽ�ⳣ��Ϊ____��
��������˵���÷�Ӧ�Ѵﵽƽ��״̬����____��
A��v��(CH3OH)=3v��(H2)
B��CO2��H2��CH3OH��H2OŨ��֮��Ϊ1��3��1��1
C�����º�ѹ�£������������ٱ仯
D�����º����£�������ܶȲ��ٱ仯
���𰸡�CO(g)+1/2O2(g)![]() CO2(g) ��H=-283kJ/mo1 ѹǿ < > 0.125mol��L1��min1 5.33(��5.3��16/3) C
CO2(g) ��H=-283kJ/mo1 ѹǿ < > 0.125mol��L1��min1 5.33(��5.3��16/3) C
��������
��1����һ�������£�1mol��ȼ����ȫȼ�������ȶ�������ʱ���ų���������ȼ���ȣ���֪������CO��ȼ����Ϊ283kJ/mo1����CO��ȼ���ȵ��Ȼ�ѧ����ʽΪCO(g)+1/2O2(g)![]() CO2(g) ��H=-283kJ/mo1��
CO2(g) ��H=-283kJ/mo1��
��2����X������CO��ƽ��ת����������˵��ƽ��������Ӧ������У���������Ӧ�������С�ķ��ȵĿ��淴Ӧ����X��ʾ����ѹǿ����ͬѹǿ�£������¶�ƽ�����淴Ӧ������У�CO��ƽ��ת���ʼ�С�����Y1��Y2��
��3���ٷ�Ӧ���е�4minʱ������̼��Ũ����Ȼ�ڼ�С��˵��ƽ��������Ӧ������У����v(��)��v(��)��0��4min�����Ķ�����̼Ũ����1.0molL��0.5mol��0.5mol/L����CO2��ƽ����Ӧ����v(CO2)=0.5mol/L��4min=0.125mol��L1��min1��
�ڸ��ݷ���ʽ��֪
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
��ʼŨ�ȣ�mol/L�� 1 3 0 0
ת��Ũ�ȣ�mol/L�� 0.75 2.25 0.75 0.75
ƽ��Ũ�ȣ�mol/L�� 0.25 0.75 0.75 0.75
����¶���ƽ�ⳣ��Ϊ![]() ��
��
��A��v��(CH3OH)=3v��(H2)���淴Ӧ���ʲ���ȣ�û�дﵽƽ��״̬��A����
B��CO2��H2��CH3OH��H2OŨ��֮��Ϊ1��3��1��1����˵�����淴Ӧ������ȣ���һ���ﵽƽ��״̬��B����
C������Ӧ�����С�����º�ѹ�£������������ٱ仯˵�����淴Ӧ������ȣ��ﵽƽ��״̬��C��ȷ��
D���ܶ��ǻ�����������������ݻ��ı�ֵ���ڷ�Ӧ�������������ݻ�ʼ���Dz���ģ�����º����£�������ܶȲ��ٱ仯����˵����Ӧ�ﵽƽ��״̬��D����
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijþȼ�ϵ����þƬ��ʯī��Ϊ�缫����ط�ӦΪ��Mg+H2O2+ H2SO4��MgSO4 +2H2O�� ��ع���ʱ������˵����ȷ����
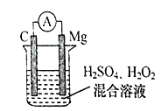
A.þƬ��������С
B.þƬ�ǵ�ص�����
C.������þƬ ����������ʯī��
D.þƬ�Ϸ�����ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������20 mL 0.1 mol��L-1 Na2CO3��Һ����μ���0.1 mol��L-1 HCl��Һ40 mL����Һ�к�̼Ԫ�صĸ�����(CO2���ݳ�δ����)���ʵ�������(����)����ҺpH�仯�IJ��������ͼ��ʾ��
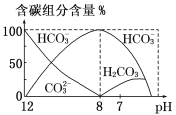
����˵����ȷ����
A. ��ͬһ��Һ�У�H2CO3��HCO3����CO32�����ܴ�������
B. ��pH��7ʱ����Һ�и�������(CO32������)�����ʵ���Ũ�ȵĴ�С��ϵΪ��c(Cl-)��c(Na+)��c(HCO3-)��c(H+)=c(OH-)
C. 0.1 mol/L Na2CO3��Һ��c(OH��)��c(H��)��c(H2CO3)��c(HCO3��)
D. �� pH��8ʱ��NaHCO3��Һ�����ʵ���Ũ��Ϊ0.1 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������2SO2(g)��O2(g) 2SO3(g)����H<0��������ͼ������˵��������ǣ� ��

A.t2ʱʹ���˴���B.t3ʱ��ȡ��С��Ӧ��ϵѹǿ�Ĵ�ʩ
C.t5ʱ��ȡ���µĴ�ʩD.��Ӧ��t6ʱ�̣�SO3����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������£�����������Һ����0.1 mol��L-1 NH4Cl��Һ����0.1 mol��L��1 CH3COONH4��Һ����0.1 mol��L��1 NH4HSO4��Һ����0.1 mol��L��1��ˮ ��0.1 mol��L��1 NH3��H2O��0.1 mol��L��1 NH4Cl���Һ
�����Ҫ����д���пհף�
(1)��Һ�ٳ�_______(������������������������)�ԣ���ԭ����___________(�����ӷ���ʽ��ʾ)��
(2)����5����Һ�У�����ˮ�ĵ���̶�������_______(�����)
(3)�������١��ڡ��ۡ�����Һ��c(NH4+)Ũ���ɴ�С��˳����_____________��(�����)
(4) �����£������Һ�ڵ�pH��7����CH3COO����NH4+Ũ�ȵĴ�С��ϵ��c(CH3COO��)______c(NH4+)(��������������������=��)��
(5)�ñ�������Һ�ζ�δ֪Ũ�ȵİ�ˮʵ�顣�ζ���ѡ�õ�ָʾ��Ϊ_______(������������ ����̪��)�������ζ���ʼʱ�ζ��ܼ��촦�����ݣ����ʱ�ζ��ܼ��촦�������ݣ���ᵼ�µζ����______(����ƫ������ ��ƫ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£���ӦA2(g)+B2(g)![]() 2AB(g)�ﵽƽ��ı�־�ǣ� ��
2AB(g)�ﵽƽ��ı�־�ǣ� ��
A.��λʱ������nmol��A2ͬʱ����nmol��AB
B.�����ڵ�ѹǿ����ʱ��仯
C.��λʱ������2nmol��ABͬʱ����nmol��B2
D.��λʱ������nmol��A2ͬʱ����nmol��B2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����գ�����ý��ױ�����������������������Ʈ���������������������͵�����ѧ����������ţ�ʳƷ���Ӽ���ʹ�����������ǵ�ע�⣬ؽ���淶��
��ż����һ��Ӧ�ýϹ㷺�����ϣ���ż������Է�������Ϊ88����ֻ����C��H��O����Ԫ�أ���ԭ�Ӹ�����Ϊ2��4��1����ż���к���̼��˫��������ż���йصķ�Ӧ���£�
��֪��HO��RCH��CHR����OH![]() RCHO+R��CHO
RCHO+R��CHO
��1����ż���ķ���ʽΪ__��G�Ľṹ��ʽΪ__��
��2����Ӧ�١��ڵķ�Ӧ����Ϊ����__����__��
��3��D��E��Ӧ�Ļ�ѧ����ʽΪ________________��
B��C��Ӧ�Ļ�ѧ����ʽΪ___________________��
��4��X����ż����ͬ���칹�壬�������࣬д��2��X���ܵĽṹ��ʽ��______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǵ�3����11~17��Ԫ��ijЩ���ʱ仯���Ƶ�����ͼ�������й�˵������ȷ����( )

A. y���ʾ�Ŀ����ǵ�һ������
B. y���ʾ�Ŀ����ǵ縺��
C. y���ʾ�Ŀ�����ԭ�Ӱ뾶
D. y���ʾ�Ŀ�����ԭ���γɼ�����ת�Ƶĵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������(NOSO4H)��Ҫ����Ⱦ�ϡ�ҽҩ�ȹ�ҵ��ʵ����������ͼװ��(�г�װ����)�Ʊ�����NOSO4H�����ⶨ��Ʒ�Ĵ��ȡ�
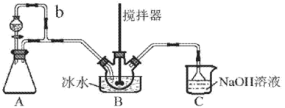
��֪��NOSO4H ��ˮ�ֽ⣬������Ũ��������ֽ⡣
(1)װ��A ���� Na2SO3 ��������ȡ SO2
��A �з�Ӧ�Ļ�ѧ����ʽΪ___________________________��
�ڵ��� b ��������_____________________��
(2)װ��C ����Ҫ������ (�����ӷ���ʽ��ʾ)_____________________��
(3)��ʵ��װ�ô��ڿ��ܵ��� NOSO4H �������͵�ȱ����___________________________��
(4)�ⶨ����������NOSO4H �Ĵ��ȣ�ȷ��ȡ 1.380g ��Ʒ���� 250mL �ĵ���ƿ�У����� 0.1000mol��L-1��60.00mL �� KMnO4 ��Һ��10mL25%H2SO4 ��Һ��ҡ�ȡ�Ȼ�� 0.2500mol��L-1 ������(Na2C2O4)��Һ�������ƿ�У����IJ�������Һ�����Ϊ 20.00mL��
��֪��2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
����ƽ��_______![]() + ______
+ ______![]() +_______=_____________Mn2++____CO2��+ _______H2O
+_______=_____________Mn2++____CO2��+ _______H2O
������������Ĵ���=__________(��ȷ�� 0.1%)(д���������)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com