
【题目】将一定量纯净的氨基甲酸铵固体置于密闭容器中,发生反应:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。该反应的平衡常数的负对数(﹣lgK)值随温度(T)的变化曲线如图所示,下列说法不正确的是
2NH3(g)+CO2(g)。该反应的平衡常数的负对数(﹣lgK)值随温度(T)的变化曲线如图所示,下列说法不正确的是

A. 该反应的△H>0
B. A点对应状态的平衡常数K(A)=10﹣2.294
C. NH3的体积分数不变时,该反应一定达到平衡状态
D. 30℃时,B点对应状态的υ(正)< υ(逆)
【答案】C
【解析】A. -lgK越大,平衡常数K越小,由图可知,随着温度升高,平衡常数K增大,则升高温度平衡正向移动,正反应为吸热反应,△H>0,故A正确;B. A点对应的-lgK=2.294,则平衡常数K(A)= 10﹣2.294,故B正确;C. 因反应物氨基甲酸铵为固体,则反应体系中气体只有NH3和CO2,反应得到NH3和CO2的物质的量之比为2:1,反应开始后NH3的体积分数始终不变,所以NH3的体积分数不变时不能说明反应达到了平衡状态,故C错误;D. 30℃时,B点的浓度商Qc大于平衡常数K,反应向逆反应方向进行,则B点对应状态的υ(正)< υ(逆),故D正确;答案选C。


科目:高中化学 来源: 题型:
【题目】德国化学家哈伯从1902 年开始研究由氮气和氢气直接合成氨,反应原理为:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJmol-1
2NH3(g) △H=-92.4kJmol-1
(1)在恒温恒容条件下,向反应平衡体系中充入氮气,达到新平衡时,c(H2)将_________(填“增大”、“减小”、“不变”或“无法判断”,下同),c(N2)·c3(H2)将___________。
(2)工业上可用CH4与水蒸气制氢气:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。在200℃时2L的密闭容器中,将1molCH4和1mol H2O(g)混合,达平衡时CH4 的转化率为80%。则200℃时该反应的平衡常数K=______________(保留一位小数)。
CO(g)+3H2(g)。在200℃时2L的密闭容器中,将1molCH4和1mol H2O(g)混合,达平衡时CH4 的转化率为80%。则200℃时该反应的平衡常数K=______________(保留一位小数)。
(3)如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3 时,平衡混合物中氨的体积分数。若分别用vA(NH3)和vB(NH3)表示从反应开始至达平衡状态A、B 时的化学反应速率,则vA(NH3)____ ( 填“>”“<”或“=”)vB(NH3)。

(4)工业生产中逸出的氨可用稀硫酸吸收。若恰好生成NH4HSO4,该溶液中各离子的物质的量浓度由大到小的顺序是______________________。
(5)H2NCOONH4是工业合成尿素的中间产物,该反应的能量变化如图所示,用CO2和氨合成尿素的热化学方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E是短周期中的5种非金属元素,它们的原子序数依次增大。A元素原子形成的离子核外电子数为零,C、D在元素周期表中处于相邻的位置,B原子的最外层电子数是内层电子数的2倍。E元素与D元素同主族; E的单质为黄色晶体,易溶于二硫化碳。
(1)请写出元素符号:
A_______,B_______,C_________,D_________,E__________。
(2)画出E的阴离子的结构示意图:__________
(3)A的单质和C的单质在一定条件下反应生成化合物X,该反应的化学方程式为_________。向X的水溶液中滴入酚酞溶液,会观察到_____________。
(4)将9g B单质在足量的D单质中燃烧,所得气体通入1L lmol/L NaOH溶液中,完全吸收后,溶液中大量存在的离子是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以某冶炼厂排放的废酸(主要成分为盐酸,含Fe2+. Pb2+. Cu2+. H3AsO3等杂质)和锌渣(含ZnO、Zn及其他酸不溶物)为原料制备电池级ZnCl2溶液的工艺流程如下:
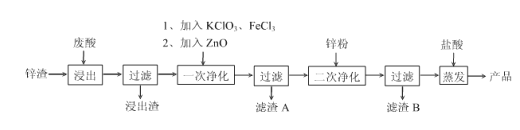
已知:Fe3+开始沉淀时pH为2.7,FeAsO4难溶于水。
回答下列问题
(1)H3AsO3(亚砷酸)中As元素的化合价是________。
(2)“浸出”时反应池应远离火源。原因是________。
(3)“一次净化”可以除去Fe、As元素,加入KClO3、FeCl3除去铁时发生反应的离子方程式为________________________,加入ZnO的目的是________________________,其余反应为KClO3+3H3AsO3 ![]() KCl+3H3AsO4 和FeCl3+H3AsO4
KCl+3H3AsO4 和FeCl3+H3AsO4![]() FeAs04+3HCl,则滤渣A的成分是________,________。
FeAs04+3HCl,则滤渣A的成分是________,________。
(4)“产品”中的主要杂质是________,避免产生该杂质的改进方案是_______________________。
(5)锌聚苯胺电池具有价格便宜、重量轻等优点,在电动汽车行业应用前景广阔。负极使用的是高纯度锌片,以ZnCl2和NH4Cl为主要电解质。锌聚苯胺电池放电时,负极材料上的电极反应式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.能电离出H+ 的化合物叫做酸
B.实验测得1mol某气体体积为22.4 L,测定条件一定是标准状况
C.摩尔是七个基本物理量之一
D.化合物分为酸、碱、盐和氧化物是用树状分类法分类的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性无色透明溶液中,下列各组离子能大量共存的是( )
A.Cu2+、K+、Cl﹣、NO3﹣
B.Ag+、Na+、NO3﹣、Cl﹣
C.Na+、Al3+、SO42﹣、Cl﹣
D.Ba2+、NH4+、Cl﹣、CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,CO和CO2的混合气体共8.96 L,质量为12.8g 则两种气体的物质的量之和为_______________mol,其中CO2为______________mol.
(2)同温同压下,同体积的甲烷(CH4)和二氧化碳物质的量之比为________,原子总数之比为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的位置关系如图。若Y原子的最外层电子数是内层电子数的3倍,则下列说法正确的是

A. 原子半径: W>Z>Y>X
B. 四种元素的单质中,Z单质的熔沸点最高
C. 最高价氧化物对应水化物的酸性:Z>W>X
D. Z的氢化物的稳定性大于W的氢化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com