
【题目】下列说法正确的是 ( )
A.氢气的燃烧热为 △H =-285.5 kJ·mol-1,则电解水的热化学方程式为2H2O(1)![]() 2H2(g)+O2(g) △H =+285.5 kJ·mol-1
2H2(g)+O2(g) △H =+285.5 kJ·mol-1
B.密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量,则Fe(s)+S(s) ===FeS(s) △H =-95.6 kJ·mol-l
C.500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2 (g)+3H2 (g) ![]() 2NH3 (g)△H =-38.6 kJ·mol-l
2NH3 (g)△H =-38.6 kJ·mol-l
D.相同条件下,在两个相同的恒容密闭容器中,1 mol N2和3 mol H2反应放出的热量与2 mol NH3分解吸收的热量一定一样多
【答案】B
【解析】
A.氢气的燃烧热指的是1mol氢气完全燃烧生成液态水时放出的热量,故电解水的热化学方程式为2H2O(1)![]() 2H2(g)+O2(g) △H =+571kJ·mol-1,A项错误;
2H2(g)+O2(g) △H =+571kJ·mol-1,A项错误;
B.11.2 g 铁粉即0.2mol,9.6 g硫粉即0.3mol,铁粉可完全反应,当0.2mol铁粉完全反应生成硫化亚铁时,放出19.12 kJ热量,则1mol 铁粉完全反应放出95.6 kJ热量,B项正确;
C.合成氨是可逆反应,0.5mol![]() (g)不可能完全转化为生成物,但ΔH描述的是完全反应的热效应,C项错误;
(g)不可能完全转化为生成物,但ΔH描述的是完全反应的热效应,C项错误;
D.相同条件下,在两个相同的恒容密闭容器中,1 mol![]() (g)和3mol
(g)和3mol![]() (g)反应与2mol
(g)反应与2mol![]() 分解的转化率不同,放出的热量不一样多,D项错误;
分解的转化率不同,放出的热量不一样多,D项错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】根据要求填空:
(1)写出有机物![]() 的名称________。
的名称________。
(2)当乙酸分子中的O都是18O时,乙醇分子中的O都是16O时,二者在一定条件下反应,生成物中水的相对分子质量为______。
(3)化学与生活息息相关。下列叙述正确的是___(填字母代号)。
A.馒头越嚼越甜 B.鲜榨橙汁遇到碘水会变蓝
C.油脂经水解可变成葡糖糖 D.土豆中的淀粉经水解可变成酒
(4)某化合物C3H6O2的核磁共振谱(NMR)中有3个峰,其强度比为3∶2∶1,则该化合物的结构简式可能为_______(写出一种即可)。
(5)瑞香素是一种具有抗菌、抗炎、抗凝血等生物活性的香豆素化合物,其分子结构如图所示。回答下列问题。
![]()
①瑞香素的化学式为____,含氧官能团名称____;
②1mol此化合物可与______molBr2反应,最多可以与____molNaOH反应。
(6)甲醛和新制氢氧化铜的反应显示了甲醛的还原性,发生反应的化学方程式通常表示为HCHO+2Cu(OH)2+NaOH![]() HCOONa+Cu2O↓+3H2O。若向足量新制氢氧化铜中加入4.00mL甲醛水溶液,充分反应。请设计一个简单实验验证甲醛的氧化产物不是甲酸盐。____。(可供选用的试剂:硫酸铜溶液、甲醛、甲酸、氢氧化钠溶液。)
HCOONa+Cu2O↓+3H2O。若向足量新制氢氧化铜中加入4.00mL甲醛水溶液,充分反应。请设计一个简单实验验证甲醛的氧化产物不是甲酸盐。____。(可供选用的试剂:硫酸铜溶液、甲醛、甲酸、氢氧化钠溶液。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作能够达到实验目的的是
|
|
|
|
A.验证一定生成SO2 | B. 用排空气法收集NO | C. 制取并检验氨气 | D.用水吸收氨气 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作规范且能达到实验目的的是
操作 | 目的 | |
A | 称取5.0gCuSO4·5H2O加入27.0g水中,搅拌溶解 | 配制10%CuSO4溶液 |
B | 先用稀盐酸洗涤,再用水清洗 | 洗涤分解KMnO4制O2的试管 |
C | 用玻璃棒蘸取溶液,点在干燥的pH试纸上,片刻后与标准比色卡比较并读数 | 测定0.05mol.L-1NaClO溶液的pH |
D | 将粗碘放入烧杯中,烧杯口放一盛满冷水的烧瓶,隔石棉网对烧杯加热,然后收集烧瓶外壁的固体 | 提纯混有NH4Cl的粗碘 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种无机矿物盐![]() 仅含四种元素
仅含四种元素![]() 的组成和性质,设计并完成了如下实验:
的组成和性质,设计并完成了如下实验: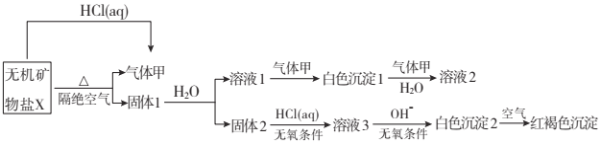
另取![]() 在惰性气流中加热至完全分解,得到
在惰性气流中加热至完全分解,得到![]() 固体1。请回答如下问题:
固体1。请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图__________,写出气体甲的电子式 __________。
(2)![]() 的化学式是__________,在惰性气流中加热X至完全分解的化学反应方程式为__________.
的化学式是__________,在惰性气流中加热X至完全分解的化学反应方程式为__________.
(3)白色沉淀2在空气中变成红褐色沉淀的原因是__________![]() 用化学反应方程式表示
用化学反应方程式表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。

(1)过滤所需要的主要玻璃仪器有___,加MgO后过滤所得滤渣的主要成分为___。
(2)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀完全?答:___。
(3)加入NaClO3饱和溶液发生反应为:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:①___;②___;③___;④过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10 mL于锥形瓶中,加入10 mL稀硫酸和20 mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00 mL。
①写出步骤2中发生反应的离子方程式:___
②产品中Mg(ClO3)2·6H2O的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Cu(s)+2H+(aq)===Cu2+(aq)+H2(g) ΔH1
2H2O2(l)===2H2O(l)+O2(g) ΔH2
2H2(g)+O2(g)===2H2O(l) ΔH3
则反应Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l)的ΔH是
A. ΔH=ΔH1+1/2ΔH2+1/2ΔH3 B. ΔH=ΔH1+1/2ΔH2-1/2ΔH3
C. ΔH=ΔH1+2ΔH2+2ΔH3 D. ΔH=2ΔH1+ΔH2+ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
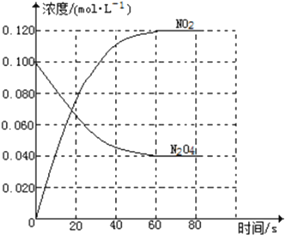
回答下列问题:
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为___________molL-1s-1反应的平衡常数K1为___________。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 molL-1s-1的平均速率降低,经10s又达到平衡。
①T_______100℃(填“大于”“小于”),判断理由是_____。
②列式计算温度T是反应的平衡常数K2___________
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向___________(填“正反应”或“逆反应”)方向移动,判断理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用多孔石墨电极完成下列实验:
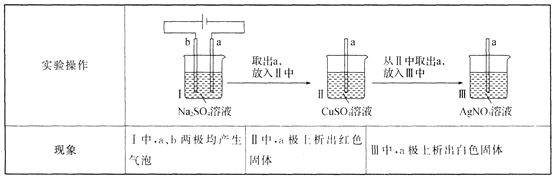
下列对实验现象的解释或推测不合理的是 ( )
A.I中,b极反应:2H2O-4e-=== O2↑+4 H+
B.Ⅱ中,析出红色固体:Cu2++H2 === Cu+2H+
C.Ⅲ中,只可能发生反应:2Ag++Cu === Cu2++2Ag
D.I中,a极上既发生了化学过程,也发生了物理过程
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com