
【题目】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。

(1)过滤所需要的主要玻璃仪器有___,加MgO后过滤所得滤渣的主要成分为___。
(2)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀完全?答:___。
(3)加入NaClO3饱和溶液发生反应为:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:①___;②___;③___;④过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10 mL于锥形瓶中,加入10 mL稀硫酸和20 mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00 mL。
①写出步骤2中发生反应的离子方程式:___
②产品中Mg(ClO3)2·6H2O的质量分数为___。
【答案】漏斗、玻璃棒、烧杯 BaSO4和Fe(OH)3 静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-沉淀完全 蒸发浓缩 趁热过滤 冷却结晶 ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O 78.3%
【解析】
卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质,加入KMnO4将FeCl2氧化成FeCl3;加入BaCl2与MgSO4反应生成BaSO4沉淀和MgCl2;加入MgO调节pH=4使FeCl3转化成Fe(OH)3沉淀,过滤所得滤渣中含BaSO4和Fe(OH)3,向滤液中加入饱和NaClO3,发生反应MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓,结合溶解度曲线,再经过蒸发浓缩、趁热过滤、冷却结晶、过滤、洗涤得到Mg(ClO3)2·6H2O。
(1)加入高锰酸钾将Fe2+氧化为Fe3+,加入氯化钡形成硫酸钡沉淀,加入氧化镁调节pH=4将Fe3+转化成氢氧化铁沉淀,过滤所得滤渣为硫酸钡和氢氧化铁,过滤需使用的玻璃仪器有漏斗、烧杯和玻璃棒。
(2)检验SO42-已经沉淀完全即检验上层清液中不含SO42-,其操作为:静置,向上层清液中继续滴加氯化钡溶液,若无白色沉淀生成,说明SO42-沉淀完全。
(3)相同条件下,四种物质中氯化钠溶解度最小,Mg(ClO3)2的溶解度随温度升高明显增大,所以加入饱和氯酸钠溶液发生反应MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓后,蒸发浓缩,氯化钠析出,趁热过滤,滤液为氯酸镁溶液,将滤液冷却结晶、过滤、洗涤得到Mg(ClO3)2·6H2O。
(4)①ClO3-具有强氧化性,Fe2+具有强还原性,ClO3-与Fe2+在酸性条件下发生氧化还原反应生成Cl-和Fe3+,离子方程式为ClO3- +6Fe2++6H+=6Fe3++Cl-+3H2O。
②根据Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,锥形瓶中过量的Fe2+物质的量n(Fe2+)=6n(Cr2O72-)=6×0.100mol/L×0.015L=0.009mol,与ClO3-反应的Fe2+为1mol/L×0.02L-0.009mol=0.011mol,所以10mL溶液中Mg(ClO3)2·6H2O物质的量为![]() ,Mg(ClO3)2·6H2O质量分数为
,Mg(ClO3)2·6H2O质量分数为 ×100%=78.3%。
×100%=78.3%。


科目:高中化学 来源: 题型:
【题目】科学家最近研制出可望成为高效火箭推进剂的![]() (如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关
(如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关![]() 的说法正确的是
的说法正确的是

A. 分子中N、O间形成的共价键是非极性键
B. 分子中四个氮原子共平面
C. 该物质既有氧化性又有还原性
D. 15.2g该物资含有6.02×![]() 个原子
个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计如下实验方案研究Cu与浓H2SO4的反应(装置中的固定仪器和酒精灯均未画出):
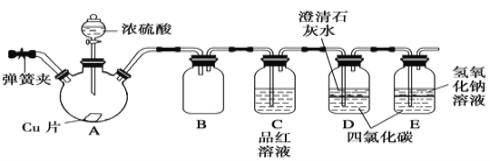
请回答下列问题:
(1)仪器A的名称_________。Cu与浓H2SO4的反应的化学方程式为________________。
(2)D、E中CCl4的作用是___________________。
(3)加热过程中,随着反应的进行,A容器下有少量白色沉淀生成,你认为该沉淀物是_________,分析可能的原因是________________________________________。
(4)实验结束,打开A容器上的弹簧夹,通入一段时间空气,目的是______________。
(5)以下提供了三种制取CuSO4溶液的方法,你认为最合理的是____________(填序号),并且写出该方法对应的化学方程式_____________________________。
① 用铜与浓硫酸制备硫酸铜溶液。
② 将铜片在空气中加热,再溶解在稀硫酸中即可得到硫酸铜溶液。
③ 在硫酸和铜的混合容器中滴加 H2O2 溶液,过滤得硫酸铜溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的叙述正确的是 ( )
A. C4H10有3种同分异构体
B. 葡萄糖、果糖的分子式均为C6H12O6,两者互为同分异构体
C. 戊烷(C5H12)有4种同分异构体
D. 主链含5个碳原子,有3个甲基支链的烷烃有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某元素的价类二维图,其中A为正盐,X是一种强碱,通常条件下Z是无色液体,E的相对分子质量比D大16,各物质的转化关系如图所示。下列说法错误的是
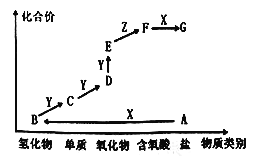
A. A作肥料时不适合与草木灰混合施用
B. 同主族元素的氢化物中B的沸点最低
C. C一般用排水法收集
D. D→E的反应可用于检验D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用。下列说法正确的是( )

A.O2在石墨Ⅱ附近发生氧化反应
B.该电池放电时NO3-向石墨Ⅱ电极迁移
C.石墨Ⅰ附近发生的反应:3NO2 +2e-=NO+ 2NO3-
D.相同条件下,放电过程中消耗的NO2和O2的体积比为4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH–+2H2O=2![]() 。下列说法正确的是( )
。下列说法正确的是( )
A.放电时,电解质溶液中K+向负极移动
B.放电时,电解质溶液中c(OH-)逐渐增大
C.放电时,负极反应为:Zn+4OH--2e-=![]()
D.放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-a kJ·mol-1。下列说法正确的是( )
2SO3(g) ΔH=-a kJ·mol-1。下列说法正确的是( )
A.在接触法制取硫酸工艺中,该反应在沸腾炉内发生
B.如果用 18O2代替O2发生上述反应,则经过一段时间可测得容器中存在S18O2、S18O3
C.2 mol SO2与2 mol O2充分反应后放出a kJ的热量
D.该反应达到平衡后,c(SO2)∶c(O2)∶c(SO3)=2∶1∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com