
【题目】下列有关有机物的叙述正确的是 ( )
A. C4H10有3种同分异构体
B. 葡萄糖、果糖的分子式均为C6H12O6,两者互为同分异构体
C. 戊烷(C5H12)有4种同分异构体
D. 主链含5个碳原子,有3个甲基支链的烷烃有5种
【答案】B
【解析】
A、C4H10属于烷烃,存在直连的正丁烷CH3CH2CH2CH3和有一个支链的异丁烷CH3CH(CH3)2两种同分异构体,选项A错误;
B.葡萄糖、果糖的分子式相同,但结构不同,属于同分异构体,选项B正确;
C、戊烷(C5H12)的同分异构体有3种,正戊烷、异戊烷和新戊烷,分别为CH3-CH2-CH2-CH2-CH3、![]() 、
、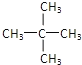 ,选项C错误;
,选项C错误;
D、主链含5个碳原子,有3个甲基支链,甲基可以在2号碳、3号碳,4号碳上,可以连在相同碳上,也可以是不同碳上,结构分别为:(CH3)3CCH(CH3)CH2CH3、(CH3)2CHC(CH3)2CH2CH3、(CH3)2CHCH(CH3)CH(CH3)2、(CH3)3CCH2CH(CH3)CH3,共4种,选项D错误;
答案选B。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】丙烯和乙烯一样,都是重要的化工原料。由丙烯经下列反应可得到F、G两种高分子化合物,它们都是常用的塑料。

(1)丙烯生成A和F的反应方程式分别为______、______。
(2)D生成E的反应是原子利用率100%的反应,且D不能使溴的四氯化碳溶液褪色,则D的结构简式为________。
(3)一定条件下,两分子E之间脱去一分子水生成一种具有芳香气味的物质。请写出反应的化学方程式_________。
(4)下列说法不正确的是_________。
A.丙烯没有同分异构体
B.聚丙烯能使高锰酸钾酸性溶液褪色
C.1 mol E与足量金属钠反应可以生成22.4 L氢气(标准状况)
D.化合物G属于酯类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下KClO3与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间,对图中各部位颜色描述正确的是

选项 | ① | ② | ③ | ④ |
A | 黄绿色 | 橙色 | 白色 | 蓝色 |
B | 无色 | 橙色 | 白色 | 紫色 |
C | 黄绿色 | 橙色 | 无色 | 蓝色 |
D | 黄绿色 | 无色 | 无色 | 紫色 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Y、Z是金属单质,F、M是极易溶于水的气体,I元素是地壳中含量仅次于氧的非金属元素,化合物L是一种可用于制造发动机的新型无机非金属材料,其相对分子质量为140,其中I元素的质量分数为60%。这些物质间的相互转化关系如框图所示(部分产物已略去),根据框图及提示的信息回答下列问题。

(1)写出I元素在元素周期表中的位置_________________________________。
(2)K和F反应生成L和M的化学方程式_________________________________________。
(3)将5.2 g 金属Z与足量的X的稀溶液充分反应无气体放出,再向溶液中加入过量的NaOH溶液并加热,收集到0.448L气体F(标准状况),则整个过程中转移的电子数为_________。
(4)C是空气质量报告中的一种气体污染物,易形成酸雨;P气体是形成另一类型酸雨的主要污染物。实验室中若想用酸性高锰酸钾溶液除尽P气体,观察到的现象应是____________________,写出相应的离子方程式______________________________ 。
(5)已知向B的溶液中加入NaOH溶液时,先产生白色沉淀,迅速变为灰绿色,最后变为红褐色,请写出过量金属Y与X的稀溶液充分反应的离子方程式 ______________,该反应中被还原的X与未被还原的X的物质的量之比为___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是
A. 碳酸钙溶于稀醋酸:CaCO3+2H+=Ca2++H2O+CO2↑
B. 铜与稀硝酸反应:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
C. 向NH4HCO3溶液中滴加过量Ba(OH)2溶液:HCO3-+OH-+Ba2+=H2O+BaCO3↓
D. 用银氨溶液检验乙醛中的醛基:CH3CHO+[Ag(NH3)2]++2OH- ![]() CH3COO-+NH4++NH3+ Ag↓+H2O
CH3COO-+NH4++NH3+ Ag↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机锌试剂(R—ZnBr)与酰氯(![]() )偶联可用于制备药物Ⅱ:
)偶联可用于制备药物Ⅱ:

(1)化合物Ⅰ的分子式为_____________。
(2)关于化合物Ⅱ,下列说法正确的有______(双选)。
A.可以发生水解反应 |
B.可与新制的Cu(OH)2共热生成红色沉淀 |
C.可与FeCl3溶液反应显紫色 |
D.可与热的浓硝酸和浓硫酸混合液反应 |
(3)化合物Ⅲ含有3个碳原子,且可发生加聚反应,按照途径1合成线路的表示方式,完成途经2中由Ⅲ到Ⅴ的合成路线:_____________(标明反应试剂,忽略反应条件)。
(4)化合物Ⅴ的核磁共振氢谱中峰的组数为_____________,以H替代化合物Ⅵ中的ZnBr,所得化合物的羧酸类同分异构体共有_____________种(不考虑手性异构)。
(5)化合物Ⅵ和Ⅶ反应可直接得到Ⅱ,则化合物Ⅶ的结构简式为:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。

(1)过滤所需要的主要玻璃仪器有___,加MgO后过滤所得滤渣的主要成分为___。
(2)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀完全?答:___。
(3)加入NaClO3饱和溶液发生反应为:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:①___;②___;③___;④过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10 mL于锥形瓶中,加入10 mL稀硫酸和20 mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00 mL。
①写出步骤2中发生反应的离子方程式:___
②产品中Mg(ClO3)2·6H2O的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸的结构简式如图,下列关于分枝酸的叙述正确的是

A. 分枝酸的分子式为C10H8O6
B. 分枝酸分子中含有2种含氧官能团
C. 可与乙醇、乙酸反应,也可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色
D. 1mol该有机物与NaOH溶液反应,最多消耗3mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日常所用锌-锰干电池的电极分别为锌筒和石墨棒,以糊状NH4Cl作电解质,电极反应为:Zn-2e-=Zn2+,2MnO2+2![]() +2e-=Mn2O3+2NH3+H2O。下列有关锌-锰干电池的叙述中,不正确的是
+2e-=Mn2O3+2NH3+H2O。下列有关锌-锰干电池的叙述中,不正确的是
A.干电池工作时,电子流动方向是由锌筒经外电路流向石墨棒
B.干电池中锌筒为负极,石墨棒为正极
C.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
D.干电池可实现化学能向电能和电能向化学能的相互转化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com