
【题目】已知Y、Z是金属单质,F、M是极易溶于水的气体,I元素是地壳中含量仅次于氧的非金属元素,化合物L是一种可用于制造发动机的新型无机非金属材料,其相对分子质量为140,其中I元素的质量分数为60%。这些物质间的相互转化关系如框图所示(部分产物已略去),根据框图及提示的信息回答下列问题。

(1)写出I元素在元素周期表中的位置_________________________________。
(2)K和F反应生成L和M的化学方程式_________________________________________。
(3)将5.2 g 金属Z与足量的X的稀溶液充分反应无气体放出,再向溶液中加入过量的NaOH溶液并加热,收集到0.448L气体F(标准状况),则整个过程中转移的电子数为_________。
(4)C是空气质量报告中的一种气体污染物,易形成酸雨;P气体是形成另一类型酸雨的主要污染物。实验室中若想用酸性高锰酸钾溶液除尽P气体,观察到的现象应是____________________,写出相应的离子方程式______________________________ 。
(5)已知向B的溶液中加入NaOH溶液时,先产生白色沉淀,迅速变为灰绿色,最后变为红褐色,请写出过量金属Y与X的稀溶液充分反应的离子方程式 ______________,该反应中被还原的X与未被还原的X的物质的量之比为___________________
【答案】第三周期第IVA族 3SiCl4+4NH3=Si3N4+12HCl 0.16NA或9.632×1022 高锰酸钾溶液紫色变浅 5 SO2+2 MnO![]() +2H2O=5 SO
+2H2O=5 SO![]() +2 Mn2++4H+ 3Fe+8H++2NO
+2 Mn2++4H+ 3Fe+8H++2NO![]() =3Fe2++2NO↑+4H2O 1:3
=3Fe2++2NO↑+4H2O 1:3
【解析】
I元素是地壳中仅次于O的非金属元素,则I为Si元素;物质G与焦炭反应生成Si,说明物质G含有Si元素,物质G为SiO2,物质H为CO;Si与Cl2在加热条件下生成物质K为SiCl4,SiCl4与物质F反应生成物质L和M,F为极易溶于水的气体,可以有物质D与NaOH溶液在加热条件下反应,说明物质F为NH3;化合物L是一种可用于制造发动机的新型无机非金属材料,其相对分子质量为140,其中I元素的质量分数为60%,其另一种元素为N元素,则物质L为Si3N4,物质M为HCl;物质D含有铵根,X的稀溶液与金属反应生成三种物质,说明X为硝酸,D为NH4NO3,物质Z与物质Y均可以与稀硝酸反应生成物质A,则物质A为水,物质E为Z的硝酸盐,据此分析。
(1)根据分析,I为Si元素,其在元素周期表中的位置为第三周期第ⅣA族;
(2)根据分析,物质K与物质F反应生成物质L和物质M的化学方程式为3SiCl4+4NH3=Si3N4+12HCl;
(3)将5.2g金属Z与足量的X的稀溶液充分反应无气体放出,再向溶液中加入过量的NaOH溶液并加热,收集到0.448L气体F(标准状况),物质F为![]() =0.02mol,0.02mol氨气全部由硝酸根得电子发生还原反应而来,一个硝酸根得8个电子生成一个铵根,故反应过程中转移电子8×0.02=0.16mol,为0.16NA个;
=0.02mol,0.02mol氨气全部由硝酸根得电子发生还原反应而来,一个硝酸根得8个电子生成一个铵根,故反应过程中转移电子8×0.02=0.16mol,为0.16NA个;
(4)C为空气质量报告中的一种气体污染物,易形成酸雨,则C为NO,则另一种气体P为SO2,利用酸性高锰酸钾除去SO2,反应方程式为5SO2+2![]() +2H2O=5
+2H2O=5![]() +2Mn2++4H+;反应现象为:高锰酸钾溶液紫色变浅;
+2Mn2++4H+;反应现象为:高锰酸钾溶液紫色变浅;
(6)向B的溶液中加入NaOH溶液时,先产生白色沉淀,迅速变为灰绿色,最后变为红褐色,说明B中含有Fe2+,结合物质X,物质B为Fe(NO3)2,则过量金属Y与X的稀溶液充分反应的离子方程式为3Fe+8H++2![]() =3Fe2++2NO↑+4H2O,反应过程中共有8mol
=3Fe2++2NO↑+4H2O,反应过程中共有8mol![]() 参加反应,反应生成2mol NO,有6mol硝酸根没有被还原,故被还原的X与为被还原的X的物质的量的比为2:6=1:3。
参加反应,反应生成2mol NO,有6mol硝酸根没有被还原,故被还原的X与为被还原的X的物质的量的比为2:6=1:3。


科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小b极质量增加 | 溶液中的 | d极溶解c极有气体产生 | 电子从d极流向a极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和所得结论错误的是 ( )
选项 | 操作 | 现象 | 结论 |
A | 向蔗糖中加入浓硫酸 | 蔗糖变成疏松多孔的海绵状炭,并放出有刺激性气味的气体 | 浓硫酸具有脱水性和强氧化性 |
B | 向久置的Na2SO3溶液中加入足量Ba(NO3)2溶液,再加入足量稀盐酸 | 先出现白色沉淀,然后部分沉淀溶解 | 部分Na2SO3被氧化 |
C | 某溶液中滴加K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | 原溶液中有Fe2+,可能有Fe3+ |
D | 向等浓度的KCl、KI混合液中逐滴滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.甲醛在木材加工、医药等方面有重要用途。甲醇直接脱氢是工业上合成甲醛的新方法,制备过程涉及的主要反应如下:
反应I:CH3OH(g)![]() HCHO(g)+H2(g) ΔH1=+85.2kJ/mol
HCHO(g)+H2(g) ΔH1=+85.2kJ/mol
反应II:CH3OH(g)+![]() O2(g)
O2(g)![]() HCHO(g)+H2O(g) ΔH2
HCHO(g)+H2O(g) ΔH2
反应III:2H2(g)+O2(g)![]() 2H2O(g) ΔH3=—483.6kJ/mol
2H2O(g) ΔH3=—483.6kJ/mol
(1)计算反应Ⅱ的反应热ΔH2=__________________。
(2)肌肉中的肌红蛋白(Mb)可与O2结合生成MbO2:Mb(aq)+O2(g)![]() MbO2(aq),其中k正和k逆分别表示正反应和逆反应的速率常数,即υ正=k正·c(Mb)·P(O2),υ逆=k逆·c(MbO2)。37℃时测得肌红蛋白的结合度(α)与P(O2)的关系如下表[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的百分比]:
MbO2(aq),其中k正和k逆分别表示正反应和逆反应的速率常数,即υ正=k正·c(Mb)·P(O2),υ逆=k逆·c(MbO2)。37℃时测得肌红蛋白的结合度(α)与P(O2)的关系如下表[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的百分比]:
①计算37℃、P(O2)为2.00kPa时,上述反应的平衡常数K=_______。
P(O2) | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
α(MbO2%) | 50.0 | 67.0 | 80.0 | 85.0 | 88.0 | 90.3 | 91.0 |
②导出平衡时肌红蛋白与O2的结合度(α)与O2的压强[P(O2)]之间的关系式α=_______(用含有k正、k逆的式子表示)。
II.CO2既是温室气体,也是重要的化工原料,以CO2为原料可合成多种有机物。
(3)CO2用于生产乙烯,已知:2CO2(g)+6H2(g)![]() CH2=CH2(g) + 4H2O(g) ΔH=QkJ/mol。一定条件下, 按不同的投料比X[X=
CH2=CH2(g) + 4H2O(g) ΔH=QkJ/mol。一定条件下, 按不同的投料比X[X=![]() ]向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。
]向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。

①X1______X2(填“>”或“<”,后同),Q______0。
②图中A、B、C三点对应的平衡常数KA、KB、KC的大小关系为______。
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3和NaHCO3。
①已知25℃时0.1mol / L的NaHCO3溶液的pH=8.3,试通过计算确定溶液中各离子浓度由大到小的顺序为_____[已知:常温下H2CO3的电离常数Ka1= 4.4×107、Ka2 = 5×1011 ]。
②欲用5LNa2CO3溶液将23.3gBaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为____。
[已知:常温下Ksp(BaSO4)=1×107、Ksp(BaCO3)=2.5×106 ]。(忽略溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计如下实验方案研究Cu与浓H2SO4的反应(装置中的固定仪器和酒精灯均未画出):
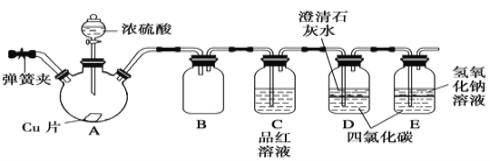
请回答下列问题:
(1)仪器A的名称_________。Cu与浓H2SO4的反应的化学方程式为________________。
(2)D、E中CCl4的作用是___________________。
(3)加热过程中,随着反应的进行,A容器下有少量白色沉淀生成,你认为该沉淀物是_________,分析可能的原因是________________________________________。
(4)实验结束,打开A容器上的弹簧夹,通入一段时间空气,目的是______________。
(5)以下提供了三种制取CuSO4溶液的方法,你认为最合理的是____________(填序号),并且写出该方法对应的化学方程式_____________________________。
① 用铜与浓硫酸制备硫酸铜溶液。
② 将铜片在空气中加热,再溶解在稀硫酸中即可得到硫酸铜溶液。
③ 在硫酸和铜的混合容器中滴加 H2O2 溶液,过滤得硫酸铜溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解足量下列溶液一段时间后,再加入一定量括号内的纯净物,能使溶液恢复到原来的成分和浓度的是
A. AgNO3[AgNO3] B. NaOH[NaOH] C. KCl[H2O] D. CuSO4[CuO]
【答案】D
【解析】石墨电极为惰性电极,溶液中阳离子在阴极放电,阴离子在阳极放电。A、电解AgNO3溶液,Ag+在阴极放电生成Ag,OH-在阳极放电生成O2,且n(Ag)∶n(O2)=2∶1,则应加入Ag2O恢复浓度,故A错误;B、电解NaOH溶液,H+在阴极放电生成H2,OH-在阳极放电生成O2,且n(H2)∶n(O2)=2∶1,则应加入一定量的H2O恢复原样,故B错误;C、电解KCl溶液,H+在阴极放电生成H2,Cl-在阳极放电生成Cl2,且n(H2)∶n(Cl2)=1∶1,则应加入一定量HCl恢复原样,故C错误;D、电解CuSO4溶液,Cu2+在阴极放电生成Cu,OH-在阳极放电生成O2,且n(Cu)∶n(O2)=2∶1,则应加入一定量CuO恢复原样,故D正确。故选D。
点睛:分析电解反应的原理,在两极析出什么物质(固体或气体),相当于什么物质脱离反应体系,根据元素守恒和原子比例,加入对应的物质,即可使溶液完全复原。
【题型】单选题
【结束】
28
【题目】工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是
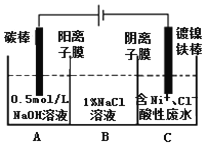
已知:①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH--4e-=O2↑+2H2O
B. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C. 为了提高Ni的产率,电解过程中需要控制废水pH
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的叙述正确的是 ( )
A. C4H10有3种同分异构体
B. 葡萄糖、果糖的分子式均为C6H12O6,两者互为同分异构体
C. 戊烷(C5H12)有4种同分异构体
D. 主链含5个碳原子,有3个甲基支链的烷烃有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用。下列说法正确的是( )

A.O2在石墨Ⅱ附近发生氧化反应
B.该电池放电时NO3-向石墨Ⅱ电极迁移
C.石墨Ⅰ附近发生的反应:3NO2 +2e-=NO+ 2NO3-
D.相同条件下,放电过程中消耗的NO2和O2的体积比为4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)CH3OH(g)△H1
②CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)CO(g)+H2O(g)△H3
回答下列问题:
(1)已知△H1=﹣99kJ·mol﹣1,已知△H2=﹣58kJ·mol﹣1,则△H3=______kJ·mol﹣1。
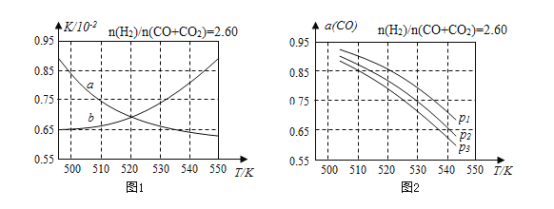
(2)反应①的化学平衡常数K的表达式为______;图1中能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母)。
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图2所示。a(CO)值随温度升高而________(填“增大”或“减小”)图2中的压强由大到小为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com