
【题目】I.甲醛在木材加工、医药等方面有重要用途。甲醇直接脱氢是工业上合成甲醛的新方法,制备过程涉及的主要反应如下:
反应I:CH3OH(g)![]() HCHO(g)+H2(g) ΔH1=+85.2kJ/mol
HCHO(g)+H2(g) ΔH1=+85.2kJ/mol
反应II:CH3OH(g)+![]() O2(g)
O2(g)![]() HCHO(g)+H2O(g) ΔH2
HCHO(g)+H2O(g) ΔH2
反应III:2H2(g)+O2(g)![]() 2H2O(g) ΔH3=—483.6kJ/mol
2H2O(g) ΔH3=—483.6kJ/mol
(1)计算反应Ⅱ的反应热ΔH2=__________________。
(2)肌肉中的肌红蛋白(Mb)可与O2结合生成MbO2:Mb(aq)+O2(g)![]() MbO2(aq),其中k正和k逆分别表示正反应和逆反应的速率常数,即υ正=k正·c(Mb)·P(O2),υ逆=k逆·c(MbO2)。37℃时测得肌红蛋白的结合度(α)与P(O2)的关系如下表[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的百分比]:
MbO2(aq),其中k正和k逆分别表示正反应和逆反应的速率常数,即υ正=k正·c(Mb)·P(O2),υ逆=k逆·c(MbO2)。37℃时测得肌红蛋白的结合度(α)与P(O2)的关系如下表[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的百分比]:
①计算37℃、P(O2)为2.00kPa时,上述反应的平衡常数K=_______。
P(O2) | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
α(MbO2%) | 50.0 | 67.0 | 80.0 | 85.0 | 88.0 | 90.3 | 91.0 |
②导出平衡时肌红蛋白与O2的结合度(α)与O2的压强[P(O2)]之间的关系式α=_______(用含有k正、k逆的式子表示)。
II.CO2既是温室气体,也是重要的化工原料,以CO2为原料可合成多种有机物。
(3)CO2用于生产乙烯,已知:2CO2(g)+6H2(g)![]() CH2=CH2(g) + 4H2O(g) ΔH=QkJ/mol。一定条件下, 按不同的投料比X[X=
CH2=CH2(g) + 4H2O(g) ΔH=QkJ/mol。一定条件下, 按不同的投料比X[X=![]() ]向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。
]向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。

①X1______X2(填“>”或“<”,后同),Q______0。
②图中A、B、C三点对应的平衡常数KA、KB、KC的大小关系为______。
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3和NaHCO3。
①已知25℃时0.1mol / L的NaHCO3溶液的pH=8.3,试通过计算确定溶液中各离子浓度由大到小的顺序为_____[已知:常温下H2CO3的电离常数Ka1= 4.4×107、Ka2 = 5×1011 ]。
②欲用5LNa2CO3溶液将23.3gBaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为____。
[已知:常温下Ksp(BaSO4)=1×107、Ksp(BaCO3)=2.5×106 ]。(忽略溶液体积的变化)
【答案】-156.6kJ/mol 2.00 ![]() > < KA>KB=KC c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) 0.52mol/L
> < KA>KB=KC c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) 0.52mol/L
【解析】
I.(1)根据盖斯定律求算。
(2)利用题给的反应式,当平衡时正、逆反应速率相等,而得出平衡常数表达式。再利用结合度的定义进行推导;
II.(3)①增大某一种反应物的用量,必然提高其它反应物的转化率;温度升高,反应物的转化率降低,说明正向是放热的;
②平衡常数是温度的函数;
(4)通过所给的电离平衡常数的数据来判断c(CO32-)与c(OH-)的相对大小;通过所给的溶度积数据和平衡常数定义式进行推导即可。
I.(1)根据盖斯定律,反应II的反应热△H2=△H1+![]() △H3=-241.8kJ/mol+85.2kJ/mol=-156.6kJ/mol;
△H3=-241.8kJ/mol+85.2kJ/mol=-156.6kJ/mol;
(2)根据所给表格中的数据可知,37℃、P(O2)=2.00kPa时,α(MbO2%)=80.0。根据反应式Mb(aq)+O2(g) ![]() MbO2(aq)并由结合度的定义可知,反应达到平衡时,反应生成的MbO2和未反应的Mb的物质的量浓度之比为4:1,
MbO2(aq)并由结合度的定义可知,反应达到平衡时,反应生成的MbO2和未反应的Mb的物质的量浓度之比为4:1,![]() 。当达到平衡时,正、逆反应速率相等,即k正c(Mb)·P(O2)=k逆c(MbO2)可得平衡常数
。当达到平衡时,正、逆反应速率相等,即k正c(Mb)·P(O2)=k逆c(MbO2)可得平衡常数![]() ;
;
②据上述推导可得平衡常数 ,变形得
,变形得![]() ,代入结合度的定义有:α=
,代入结合度的定义有:α=![]() =
= ;
;
II.(3)①X=![]() ,X越大,表明相对CO2来说,H2的投入料越多,而CO2的转化率就越大,所以X1>X2;从图中可以看出,随着温度的升高,CO2的转化率降低,说明升温平衡左移,该反应正向是放热反应,即Q<0;
,X越大,表明相对CO2来说,H2的投入料越多,而CO2的转化率就越大,所以X1>X2;从图中可以看出,随着温度的升高,CO2的转化率降低,说明升温平衡左移,该反应正向是放热反应,即Q<0;
②B和C点对应的温度相同,所以平衡常数相同,C点相对于A点是升高温度,由于正向是放热反应,所以升高温度平衡常数将减小,所以A、B、C三点的平衡常数的大小关系为:KA>KB=KC;
(4)①0.1mol/LNaHCO3溶液的pH=8.3,可初步得出溶液中离子浓度大小关系为:c(Na+)>c(HCO3-)>c(OH-)>(H+),再计算确定c(CO32-)和c(OH-)的相对大小。据pH=8.3可知c(OH-)=10-5.7mol/L;据![]() ,计算可得c(CO32-)=5×10-3.7mol/L>c(OH-),所以溶液中离子浓度的大小顺序为:c(Na+)>c(HCO3-)> c(CO32-)>c(OH-)>(H+);
,计算可得c(CO32-)=5×10-3.7mol/L>c(OH-),所以溶液中离子浓度的大小顺序为:c(Na+)>c(HCO3-)> c(CO32-)>c(OH-)>(H+);
②设固体全部转化时至少需要Na2CO3溶液的物质的量浓度为x,当BaSO4完全溶解后,所得5L溶液中c(SO42-)=![]() ÷5L=0.02mol/L,此时溶液中的c(CO32-)=(x-0.02)mol/L,由BaSO4
÷5L=0.02mol/L,此时溶液中的c(CO32-)=(x-0.02)mol/L,由BaSO4![]() BaCO3(s)+SO42-(aq)可知,此反应的平衡常数
BaCO3(s)+SO42-(aq)可知,此反应的平衡常数![]() ,解得x=0.52mol/L;
,解得x=0.52mol/L;


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】月桂烯(![]() )是重要的化工原料,广泛用于香料行业。
)是重要的化工原料,广泛用于香料行业。
(1)月桂烯与足量氢气完全加成后生成A,A的名称是_________________________;
(2)以月桂烯为原料制取乙酸香叶酯的流程如下图:
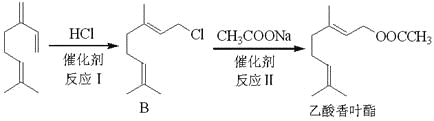
①B中官能团的名称______________________;
②乙酸香叶酯的化学式____________________;
③反应Ⅰ的反应类型是____________________;
④反应Ⅱ的化学方程式是__________________________________________________;
(3)已知:烯烃臭氧化还原水解反应生成羰基化合物,如:

一定条件下,月桂烯可实现如下图所示转化(图中部分产物已略去):
![]()
①C与新制的Cu(OH)2悬浊液反应的化学方程式为:
_______________________________________________________________;
②E在一定条件下能发生缩聚反应,写出其产物的结构简式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①Ar ②Na2O2 ③CCl4 ④HClO ⑤N2 ⑥MgF2 ⑦NH4Cl
(1)只存在共价键的是__,不存在化学键的是__,离子化合物有__。
(2)由离子键和极性键构成的物质是__。
(3)N2的电子式为__,HClO的电子式为__,NH4Cl的电子式为__。
(4)用电子式表示MgF2的形成过程__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电解法生产金属锰产生的阳极泥中,其锰含量高达40%~50%,主要成分为MnO2的水合物,且含有显著量的Pb2+、Sn2+等重金属杂质.本工艺采用的木屑富含的纤维素在较浓硫酸的作用下膨胀、水解生成还原糖,酸性条件下,可与二氧化锰反应生成可溶性的硫酸锰。

(1)工业上电解硫酸锰的水溶液生产金属锰,阳极的电极反应式为_____________。
(2)写出木屑水解反应的化学方程式:___________
配平浸出步骤反应方程式C6H12O6+MnO2+H2SO4→MnSO4+CO2+H2O_________________
(3)若取消除酸操作步骤,将会产生气体_____________(填化学式)而污染环境;
(4)本工艺的一种副产品是重要的农业生产资料,写出其化学式____;
(5)取一定量的阳极泥进行实验分析,得到如图象。硫酸的最合适用量为________mL,若再增加硫酸的用量,将会导致____________(填化学式)的消耗量增大。

(6)某阳极泥中MnO2(相对分子质量为87)的质量分数为50.0%,将174g该阳极泥与320g36.5%的浓盐酸混合加热,则产生的氯气在标准状况下应少于_________L。(假设阳极泥中的其它成分不参与反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下KClO3与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间,对图中各部位颜色描述正确的是

选项 | ① | ② | ③ | ④ |
A | 黄绿色 | 橙色 | 白色 | 蓝色 |
B | 无色 | 橙色 | 白色 | 紫色 |
C | 黄绿色 | 橙色 | 无色 | 蓝色 |
D | 黄绿色 | 无色 | 无色 | 紫色 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法正确的是
A. 元素周期表是按照元素相对原子质量大小排列而成的
B. 元素周期表有7个横行,也是7个周期;有18个纵行,即18个族
C. 凡是位于元素周期表中同一周期的元素,都是按从左到右的顺序原子最外层电子数由1递增到8
D. 凡是位于元素周期表中同一主族的元素,都是按从上到下的顺序电子层数逐渐增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Y、Z是金属单质,F、M是极易溶于水的气体,I元素是地壳中含量仅次于氧的非金属元素,化合物L是一种可用于制造发动机的新型无机非金属材料,其相对分子质量为140,其中I元素的质量分数为60%。这些物质间的相互转化关系如框图所示(部分产物已略去),根据框图及提示的信息回答下列问题。

(1)写出I元素在元素周期表中的位置_________________________________。
(2)K和F反应生成L和M的化学方程式_________________________________________。
(3)将5.2 g 金属Z与足量的X的稀溶液充分反应无气体放出,再向溶液中加入过量的NaOH溶液并加热,收集到0.448L气体F(标准状况),则整个过程中转移的电子数为_________。
(4)C是空气质量报告中的一种气体污染物,易形成酸雨;P气体是形成另一类型酸雨的主要污染物。实验室中若想用酸性高锰酸钾溶液除尽P气体,观察到的现象应是____________________,写出相应的离子方程式______________________________ 。
(5)已知向B的溶液中加入NaOH溶液时,先产生白色沉淀,迅速变为灰绿色,最后变为红褐色,请写出过量金属Y与X的稀溶液充分反应的离子方程式 ______________,该反应中被还原的X与未被还原的X的物质的量之比为___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机锌试剂(R—ZnBr)与酰氯(![]() )偶联可用于制备药物Ⅱ:
)偶联可用于制备药物Ⅱ:

(1)化合物Ⅰ的分子式为_____________。
(2)关于化合物Ⅱ,下列说法正确的有______(双选)。
A.可以发生水解反应 |
B.可与新制的Cu(OH)2共热生成红色沉淀 |
C.可与FeCl3溶液反应显紫色 |
D.可与热的浓硝酸和浓硫酸混合液反应 |
(3)化合物Ⅲ含有3个碳原子,且可发生加聚反应,按照途径1合成线路的表示方式,完成途经2中由Ⅲ到Ⅴ的合成路线:_____________(标明反应试剂,忽略反应条件)。
(4)化合物Ⅴ的核磁共振氢谱中峰的组数为_____________,以H替代化合物Ⅵ中的ZnBr,所得化合物的羧酸类同分异构体共有_____________种(不考虑手性异构)。
(5)化合物Ⅵ和Ⅶ反应可直接得到Ⅱ,则化合物Ⅶ的结构简式为:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界某著名学术刊物介绍了一种新型中温全瓷铁空气电池,其结构如图所示。

下列有关该电池放电时的说法正确的是( )
A.a极发生氧化反应
B.铁表面发生的反应为xH2O(g)+Fe=FeOx+xH2
C.若有22.4 L(标准状况)空气参与反应,则电路中有4 mol电子转移
D.正极的电极反应式为FeOx+2xe-=Fe+xO2-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com