
【题目】甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)CH3OH(g)△H1
②CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)CO(g)+H2O(g)△H3
回答下列问题:
(1)已知△H1=﹣99kJ·mol﹣1,已知△H2=﹣58kJ·mol﹣1,则△H3=______kJ·mol﹣1。
(2)反应①的化学平衡常数K的表达式为______;图1中能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母)。
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图2所示。a(CO)值随温度升高而________(填“增大”或“减小”)图2中的压强由大到小为________。
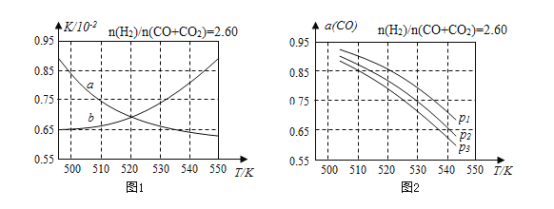
【答案】+41 c(CH3OH)/c(CO)c2(H2) a 减小 P1>P2>P3
【解析】
(1)根据盖斯定律分析解答;
(2)化学平衡常数指可逆反应达到平衡时,各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;化学平衡常数只受温度影响,根据温度对平衡移动的影响,进而判断温度对平衡常数的影响;
(3)由图2可知,压强一定时,根据温度对平衡的影响分析判断;相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①②正反应为气体分子减小的反应,根据压强对平衡的影响分析判断。
(1)①CO(g)+2H2(g)CH3OH(g)△H1,②CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2,③CO2(g)+H2(g)CO(g)+H2O(g)△H3,根据盖斯定律:反应②-反应①=反应③,故△H3=△H2-△H1=-58kJ·mol-1-(-99kJ·mol-1)=+41kJ·mol-1,故答案为:+41;
(2)反应①CO(g)+2H2(g)CH3OH(g)的平衡常数表达式K= ;反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,曲线a正确反映平衡常数K随温度变化关系,故答案为:
;反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,曲线a正确反映平衡常数K随温度变化关系,故答案为: ;a;
;a;
(3)由图2可知,压强一定时,随温度的升高,CO的转化率减小;相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①②正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高,故压强:P1>P2>P3,故答案为:减小;P1>P2>P3。


科目:高中化学 来源: 题型:
【题目】已知Y、Z是金属单质,F、M是极易溶于水的气体,I元素是地壳中含量仅次于氧的非金属元素,化合物L是一种可用于制造发动机的新型无机非金属材料,其相对分子质量为140,其中I元素的质量分数为60%。这些物质间的相互转化关系如框图所示(部分产物已略去),根据框图及提示的信息回答下列问题。

(1)写出I元素在元素周期表中的位置_________________________________。
(2)K和F反应生成L和M的化学方程式_________________________________________。
(3)将5.2 g 金属Z与足量的X的稀溶液充分反应无气体放出,再向溶液中加入过量的NaOH溶液并加热,收集到0.448L气体F(标准状况),则整个过程中转移的电子数为_________。
(4)C是空气质量报告中的一种气体污染物,易形成酸雨;P气体是形成另一类型酸雨的主要污染物。实验室中若想用酸性高锰酸钾溶液除尽P气体,观察到的现象应是____________________,写出相应的离子方程式______________________________ 。
(5)已知向B的溶液中加入NaOH溶液时,先产生白色沉淀,迅速变为灰绿色,最后变为红褐色,请写出过量金属Y与X的稀溶液充分反应的离子方程式 ______________,该反应中被还原的X与未被还原的X的物质的量之比为___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸的结构简式如图,下列关于分枝酸的叙述正确的是

A. 分枝酸的分子式为C10H8O6
B. 分枝酸分子中含有2种含氧官能团
C. 可与乙醇、乙酸反应,也可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色
D. 1mol该有机物与NaOH溶液反应,最多消耗3mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界某著名学术刊物介绍了一种新型中温全瓷铁空气电池,其结构如图所示。

下列有关该电池放电时的说法正确的是( )
A.a极发生氧化反应
B.铁表面发生的反应为xH2O(g)+Fe=FeOx+xH2
C.若有22.4 L(标准状况)空气参与反应,则电路中有4 mol电子转移
D.正极的电极反应式为FeOx+2xe-=Fe+xO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚乙烯酯是锂离子电池低温电解液的重要添加剂,其结构如图,下列有关该物质的说法正确的是
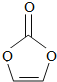
A. 分子式为C3H4O3
B. 1mol该分子能与2molH2加成
C. 分子中只有极性键
D. 标准状况下8.6g该物质完全燃烧得到6.72LCO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是元素周期表的部分轮廓图,根据元素①~⑩在周期表中的位置按题目要求回答:
① | |||||||||||||||||
② | ③ | ④ | |||||||||||||||
⑤ | ⑥ | ⑦ | ⑧ | ||||||||||||||
⑨ | |||||||||||||||||
⑩ |
(1)写出由元素①③④按原子个数比4:2:3组成的物质的化学式_______,其含有的化学键类型有________。
(2)元素⑤~⑧形成的简单离子中,离子半径由大到小的顺序为____________(用离子符号表示)。
(3)元素③⑦⑨的简单气态氢化物沸点由高到低的顺序排列是______(用化学式表示)。
(4)写出元素⑩的原子结构示意图______。
(5)元素②和④组成的一种化合物是引起温室效应的主要气体,其电子式为_________,将少量该化合物通入由元素④⑤⑥组成的一种盐溶液中,写出相应的化学方程式_____。
(6)元素⑧的一种氧化物通入氯化钡溶液无沉淀,通入硝酸钡溶液却会产生白色沉淀,写出少量该氧化物通入硝酸钡溶液的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日常所用锌-锰干电池的电极分别为锌筒和石墨棒,以糊状NH4Cl作电解质,电极反应为:Zn-2e-=Zn2+,2MnO2+2![]() +2e-=Mn2O3+2NH3+H2O。下列有关锌-锰干电池的叙述中,不正确的是
+2e-=Mn2O3+2NH3+H2O。下列有关锌-锰干电池的叙述中,不正确的是
A.干电池工作时,电子流动方向是由锌筒经外电路流向石墨棒
B.干电池中锌筒为负极,石墨棒为正极
C.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
D.干电池可实现化学能向电能和电能向化学能的相互转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度下,将3molA和2mol B充入一密闭容器中,发生反应:aA(g)+B(g)![]() C(g)+D(g),5min后达平衡,各物质的平衡浓度的关系为ca(A)·c(B)=c(C)·c(D)。若在温度不变的情况下将容器的体积扩大为原来的10倍,B的转化率不发生变化,则B的转化率为
C(g)+D(g),5min后达平衡,各物质的平衡浓度的关系为ca(A)·c(B)=c(C)·c(D)。若在温度不变的情况下将容器的体积扩大为原来的10倍,B的转化率不发生变化,则B的转化率为
A. 60%B. 40%C. 24%D. 4%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水FeCl3呈棕红色,极易潮解, 100 ℃ 左右时升华,工业上常用作有机合成催化剂。实验室可用下列装置(夹持仪器略去)制备并收集无水FeCl3。
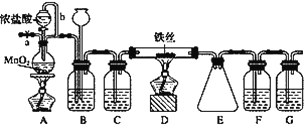
(1)装置A中反应的离子方程式为____________________________________________。
(2)装置F中所加的试剂为________。
(3)导管b的作用为________________________________________________________;
装置B的作用为__________________________________________________________。
(4)实验时应先点燃A处的酒精灯,反应一会儿后,再点燃D处的酒精灯,原因为______________________________。
(5)为检验所得产品为FeCl3,可进行如下实验:取E中收集的产物少许,加水溶解,向所得溶液中加入____________, ___________(填试剂名称和现象)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com