
【题目】下图所示是元素周期表的部分轮廓图,根据元素①~⑩在周期表中的位置按题目要求回答:
① | |||||||||||||||||
② | ③ | ④ | |||||||||||||||
⑤ | ⑥ | ⑦ | ⑧ | ||||||||||||||
⑨ | |||||||||||||||||
⑩ |
(1)写出由元素①③④按原子个数比4:2:3组成的物质的化学式_______,其含有的化学键类型有________。
(2)元素⑤~⑧形成的简单离子中,离子半径由大到小的顺序为____________(用离子符号表示)。
(3)元素③⑦⑨的简单气态氢化物沸点由高到低的顺序排列是______(用化学式表示)。
(4)写出元素⑩的原子结构示意图______。
(5)元素②和④组成的一种化合物是引起温室效应的主要气体,其电子式为_________,将少量该化合物通入由元素④⑤⑥组成的一种盐溶液中,写出相应的化学方程式_____。
(6)元素⑧的一种氧化物通入氯化钡溶液无沉淀,通入硝酸钡溶液却会产生白色沉淀,写出少量该氧化物通入硝酸钡溶液的离子方程式___。
【答案】NH4NO3 离子键、(极性)共价键 P3- >S2- > Na+ > Al3+ NH3 >AsH3 > PH3 
![]() CO2+2NaAlO2+3H2O==2Al(OH)3↓+Na2CO3 3SO2+3Ba2++2
CO2+2NaAlO2+3H2O==2Al(OH)3↓+Na2CO3 3SO2+3Ba2++2![]() +2H2O==3BaSO4↓+2NO↑+4H+
+2H2O==3BaSO4↓+2NO↑+4H+
【解析】
根据元素在周期表的结构判断元素种类,根据元素周期律及物质性质分析解答。
由元素在周期表中位置,可知①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为P,⑧为S,⑨为As,⑩为Rb,
(1) H、N、O按按原子个数比4:2:3组成的物质的化学式为NH4NO3,铵根离子与硝酸根离子间存在离子键,硝酸根离子中N与O以共价键结合,则化学键类型有离子键、(极性)共价键,故答案为:NH4NO3;离子键、(极性)共价键;
(2) 元素⑤~⑧形成的简单离子中,电子层数越多,半径越大,核外电子数相同时,核电荷越大,半径越小,则离子半径由大到小的顺序为P3->S2-> Na+> Al3+,故答案为:P3->S2-> Na+> Al3+;
(3) 组成和结构相似的物质,相对分子质量越大,分子间作用力越大,沸点越高,则沸点AsH3> PH3,NH3分子间存在氢键,则沸点最高,故沸点由高到低的顺序排列是NH3>AsH3> PH3,故答案为:NH3>AsH3> PH3;
(4) Rb在元素周期表中第五周期IA族,共有5个电子层,最外层电子数为1,则原子结构示意图 ,故答案为:
,故答案为: ;
;
(5) 元素C和O组成的一种化合物为CO2,是引起温室效应的主要气体,其电子式为![]() ,将少量二氧化碳通入偏铝酸钠溶液中反应生成氢氧化铝沉淀和碳酸钠,化学方程式为:CO2+2NaAlO2+3H2O==2Al(OH)3↓+Na2CO3,故答案为:
,将少量二氧化碳通入偏铝酸钠溶液中反应生成氢氧化铝沉淀和碳酸钠,化学方程式为:CO2+2NaAlO2+3H2O==2Al(OH)3↓+Na2CO3,故答案为:![]() ;CO2+2NaAlO2+3H2O==2Al(OH)3↓+Na2CO3;
;CO2+2NaAlO2+3H2O==2Al(OH)3↓+Na2CO3;
(6) 元素S的一种氧化物通入氯化钡溶液无沉淀,通入硝酸钡溶液却会产生白色沉淀,则该氧化物为SO2,反应离子方程式为:3SO2+3Ba2++2![]() +2H2O=3BaSO4↓+2NO↑+4H+,故答案为:3SO2+3Ba2++2
+2H2O=3BaSO4↓+2NO↑+4H+,故答案为:3SO2+3Ba2++2![]() +2H2O=3BaSO4↓+2NO↑+4H+。
+2H2O=3BaSO4↓+2NO↑+4H+。


 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】用惰性电极电解足量下列溶液一段时间后,再加入一定量括号内的纯净物,能使溶液恢复到原来的成分和浓度的是
A. AgNO3[AgNO3] B. NaOH[NaOH] C. KCl[H2O] D. CuSO4[CuO]
【答案】D
【解析】石墨电极为惰性电极,溶液中阳离子在阴极放电,阴离子在阳极放电。A、电解AgNO3溶液,Ag+在阴极放电生成Ag,OH-在阳极放电生成O2,且n(Ag)∶n(O2)=2∶1,则应加入Ag2O恢复浓度,故A错误;B、电解NaOH溶液,H+在阴极放电生成H2,OH-在阳极放电生成O2,且n(H2)∶n(O2)=2∶1,则应加入一定量的H2O恢复原样,故B错误;C、电解KCl溶液,H+在阴极放电生成H2,Cl-在阳极放电生成Cl2,且n(H2)∶n(Cl2)=1∶1,则应加入一定量HCl恢复原样,故C错误;D、电解CuSO4溶液,Cu2+在阴极放电生成Cu,OH-在阳极放电生成O2,且n(Cu)∶n(O2)=2∶1,则应加入一定量CuO恢复原样,故D正确。故选D。
点睛:分析电解反应的原理,在两极析出什么物质(固体或气体),相当于什么物质脱离反应体系,根据元素守恒和原子比例,加入对应的物质,即可使溶液完全复原。
【题型】单选题
【结束】
28
【题目】工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是
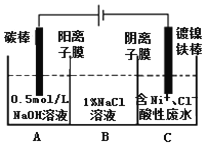
已知:①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH--4e-=O2↑+2H2O
B. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C. 为了提高Ni的产率,电解过程中需要控制废水pH
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.用浓盐酸酸化的KMnO4溶液氧化H2C2O4:6H++5H2C2O4+2MnO4-=10CO2↑+2Mn2++8H2O
B.向Ca(HCO3)2溶液中滴加入少量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C.向Fe(NO3)3溶液中加入过量的HI溶液:2NO3-+8H++6I-=3I2+2NO↑+4H2O
D.用石墨电极电解MgCl2溶液:Mg2++2Cl-+2H2O![]() Mg(OH)2↓+H2↑+Cl2↑
Mg(OH)2↓+H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中,在一定条件下发生反应:2AB(g)+C(s),且达到平衡,当升高温度时,容器内气体的密度变大,则下列判断正确的是( )
A.若正反应为吸热反应,则A为气态
B.若正反应为放热反应,则A为非气态
C.若在平衡体系中加入少量C,则该平衡逆向移动
D.若改变温度,气体的平均摩尔质量不变,则A一定为非气态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)CH3OH(g)△H1
②CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)CO(g)+H2O(g)△H3
回答下列问题:
(1)已知△H1=﹣99kJ·mol﹣1,已知△H2=﹣58kJ·mol﹣1,则△H3=______kJ·mol﹣1。
(2)反应①的化学平衡常数K的表达式为______;图1中能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母)。
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图2所示。a(CO)值随温度升高而________(填“增大”或“减小”)图2中的压强由大到小为________。
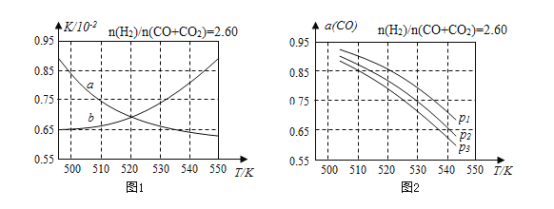
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属的工业制法中,正确的是
A. 以海水为原料制得精盐,再电解精盐的水溶液制取钠
B. 用海水、石灰乳等为原料,经一系列过程制得氧化镁,用H2还原氧化镁制得镁
C. 以铁矿石、焦炭、空气、石灰石等为原料,通过反应产生的CO在高温下还原铁矿石制得铁
D. 从铝土矿中获得氧化铝再制得氯化铝固体,电解熔融的氯化铝得到铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)可用作有机化学的氯化剂,在药物和染料的制取中也有重要作用。某化学学习小组拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯。反应的化学方程式为:SO2(g)+ Cl2(g) =SO2Cl2(l) ΔH =97.3 kJ·mol1,实验装置如图所示(部分夹持装置未画出)。
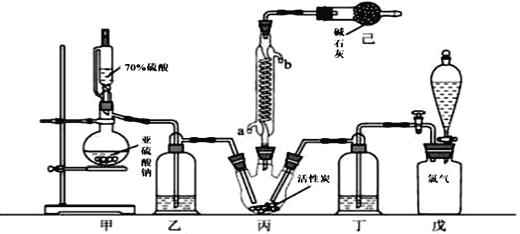
已知:硫酰氯通常条件下为无色液体,熔点54.1℃,沸点69.1℃。在潮湿空气中“发烟”;100°C以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
回答下列问题:
(1)装置甲中作为反应容器的仪器的名称为________,装置己的作用是________;如何控制两种反应物体积相等:________。
(2)装置戊上方分液漏斗中最好选用下列试剂:(_______)(选填字母)。
A.蒸馏水 B.饱和食盐水 C.浓氢氧化钠溶液 D.6.0 molL1盐酸
(3)若缺少装置乙和丁(均盛放浓硫酸),潮湿氯气和二氧化硫发生反应的化学方程式是________________________________________。
(4)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯:2ClSO3H =SO2Cl2 + H2SO4,分离两种产物的方法是(_______) (选填字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(5)长期储存的硫酰氯会发黄,可能的原因是________ (用化学方程式和必要的文字加以解释)。
(6)若反应中消耗的氯气体积为896 mL(标准状况下),最后经过分离提纯得到4.05 g纯净的硫酰氯,则硫酰氯的产率为________。为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有________________ ________________________________________ (写两条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙是电化学实验装置,请回答下列问题:

(1)若甲、乙两个烧杯中均盛放饱和NaCl溶液。
①甲中石墨棒上的电极反应式是____________。
②将湿润的淀粉KI试纸放在乙烧杯的上方,发现试纸先变蓝后褪色,这是因为电解生成的某种气体A氧化了I-生成了I2。若A气体和I2按物质的量之比为5∶1反应,且生成两种酸,该反应的化学方程式为_________。
③如果不考虑气体产物与烧杯中溶液之间的反应,当乙反应有0.01 mol电子转移后停止实验,烧杯中溶液的体积为100 mL,则溶液混匀后的c(OH-)=_____。
(2)若甲、乙两烧杯中均盛放CuSO4溶液。
①甲中铁棒上的电极反应式为_______________。
②乙中总反应的离子方程式为_________________。
③如果起始时乙中盛放100 mL pH=5的CuSO4溶液(25℃),一段时间后溶液的c(H+)=0.1mol/L,若要使溶液恢复到起始时的浓度(忽略溶液体积的变化),可向溶液中加入_____ (填写物质的化学式)______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酚酞含片是一种治疗消化系统疾病的药物,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )
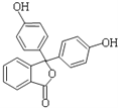
A. 核磁共振氢谱中有5个峰
B. 最多有14个碳原子共平面
C. 可能发生缩聚反应生成高分子化合物
D. 1mol该物质最多能与含4molNaOH的烧碱溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com