
【题目】硫酰氯(SO2Cl2)可用作有机化学的氯化剂,在药物和染料的制取中也有重要作用。某化学学习小组拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯。反应的化学方程式为:SO2(g)+ Cl2(g) =SO2Cl2(l) ΔH =97.3 kJ·mol1,实验装置如图所示(部分夹持装置未画出)。
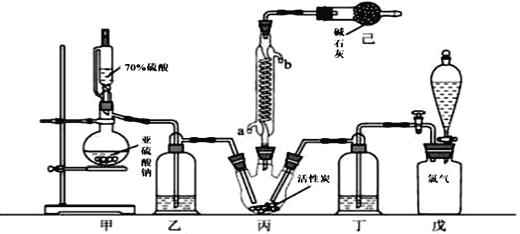
已知:硫酰氯通常条件下为无色液体,熔点54.1℃,沸点69.1℃。在潮湿空气中“发烟”;100°C以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
回答下列问题:
(1)装置甲中作为反应容器的仪器的名称为________,装置己的作用是________;如何控制两种反应物体积相等:________。
(2)装置戊上方分液漏斗中最好选用下列试剂:(_______)(选填字母)。
A.蒸馏水 B.饱和食盐水 C.浓氢氧化钠溶液 D.6.0 molL1盐酸
(3)若缺少装置乙和丁(均盛放浓硫酸),潮湿氯气和二氧化硫发生反应的化学方程式是________________________________________。
(4)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯:2ClSO3H =SO2Cl2 + H2SO4,分离两种产物的方法是(_______) (选填字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(5)长期储存的硫酰氯会发黄,可能的原因是________ (用化学方程式和必要的文字加以解释)。
(6)若反应中消耗的氯气体积为896 mL(标准状况下),最后经过分离提纯得到4.05 g纯净的硫酰氯,则硫酰氯的产率为________。为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有________________ ________________________________________ (写两条即可)。
【答案】 蒸馏烧瓶 吸收尾气并防止空气中的水蒸气进入装置丙中 通过调节旋塞或滴液的快慢控制气流的流速,使装置乙和丁导管口产生的气泡的速率相等 B Cl2+SO2+2H2O=2HCl+H2SO4 C SO2Cl2=Cl2+SO2分解产生的少量氯气溶解在其中 75% ①先通冷凝水,再通气。![]() 控制气体流速,宜慢不宜快
控制气体流速,宜慢不宜快 ![]() 若三颈烧瓶发烫,可适当降温。
若三颈烧瓶发烫,可适当降温。![]() 保证装置的气密性良好。
保证装置的气密性良好。
【解析】(1)装置甲中作为反应容器的仪器的名称为蒸馏烧瓶;己中装有碱石灰,既能吸收反应剩余的尾气,又能防止空气中水蒸气进入丙装置;通过调节旋塞控制液体滴加快慢,观察乙、丁装置内气泡的速率变化来实现;正确答案:蒸馏烧瓶; 吸收尾气并防止空气中的水蒸气进入装置丙中;通过调节旋塞或滴液的快慢控制气流的流速,使装置乙和丁导管口产生的气泡的速率相等。
(2)选择试剂的条件:氯气不溶于该溶液,也不与该溶液发生反应;氯气能够溶于水且与水反应,不能选择,A错误;氯气能够与浓氢氧化钠溶液反应,得不到氯气,不能选择,C错误;浓盐酸具有挥发性,导致氯气中混有氯化氢气体,也不能选,D错误;氯气在饱和食盐水溶解度最小,这是最好的选择;正确选项C。
(3)潮湿氯气和二氧化硫发生反应生成硫酸和盐酸,化学方程式是Cl2+SO2+2H2O=2HCl+H2SO4 ;正确选项:Cl2+SO2+2H2O=2HCl+H2SO4。
(4)根据题给信息,硫酰氯与硫酸互溶,且硫酰氯的沸点较低,可以采用蒸馏的方法进行分离;正确选项C。
(5)根据题给信息,SO2Cl2长期放置分解生成二氧化硫和氯气,分解产生的少量氯气溶解在其中 ,导致长期储存的硫酰氯会发黄,反应方程式SO2Cl2=Cl2+SO2;正确答案:SO2Cl2=Cl2+SO2,分解产生的少量氯气溶解在其中。
(6)根据氯元素守恒规律,理论上制得硫酰氯的量为n(Cl2)=n(SO2Cl2)=0.896/22.4=0.04mol,SO2Cl2质量为m (SO2Cl2)=0.04×135=5.4g,硫酰氯的产率为4.05 /5.4×100%=75%;为提高本实验中硫酰氯的产率,①先通冷凝水,再通气;![]() 控制气体流速,宜慢不宜快 ;正确答案:75%;①先通冷凝水,再通气;
控制气体流速,宜慢不宜快 ;正确答案:75%;①先通冷凝水,再通气;![]() 控制气体流速,宜慢不宜快。
控制气体流速,宜慢不宜快。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】2017年11月联合国气候大会在德国波恩开幕,CO2的回收利用再一次提上了日程。
I利用CO2制取丙烯(C3H6)
(1)用CO2催化加氢可制取丙烯的原理为:3CO2(g)+9H2(g) ![]() C3H6(g)+6H2O(g) △H。
C3H6(g)+6H2O(g) △H。
已知热化学方程式如下
①2C2H6(g)+9O2(g)=6CO2(g)+6H2O(l) △H1;
②2H2O(g)=2H2(g)+O2(g) ΔH2;
③H2O(g)==H2O(l) △H3;
则制取丙烯反应的△H= ______(用△H1、△H2、△H3表示)。
(2)以稀磷酸为电解质溶液,以石墨为电极,利用太阳能电池将CO2转化为丙烯的工作原理如下图所示。
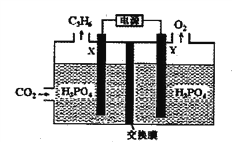
①电解池中的交换膜为_______ :(填“阴”或“阳")离子交换膜,通过交换的离子是_______(填离子符号)。
②阴极的电极反应为_____________________________。
II.利用CO2制取二甲醚(CH3OCH3)
(3)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料
CH3OCH3(g)+3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料
比n(H2)/n(CO2)]的变化曲线如下左图:
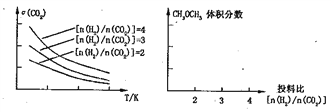
①在其他条件不变时,在右图中画出平衡时CH3OCH3的体积分数随投料比n(H2)/n(CO2)交化的曲线图____________。
②某温度下将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如下图所示,关于温度和压强的关系判断正确的是____________。
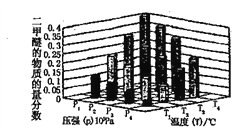
A.P4>P3>P2>P1 B .T4>T3>T2>T1 C.P1>P2>P3>P4 D. T1>T2>T3>T4.
III利用CO2制取甲醇(CH3OH)
用CO2催化加氢制取甲醇的反应为CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-b kJ·mol—1(b>0)。T℃时,将 1 mol CO2和4molH2充入的密闭溶液中,测得H2的物质的量随时间变化如图中实线所示
CH3OH(g)+H2O(g) △H=-b kJ·mol—1(b>0)。T℃时,将 1 mol CO2和4molH2充入的密闭溶液中,测得H2的物质的量随时间变化如图中实线所示
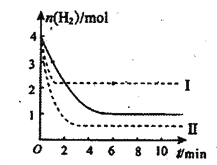
(4)不能证明该反应达到化学平衡状态的是___________。
A.气体的总压强不变
B. CH3 OH(g)和H2O(g)的物质的量之比不变
C.混合气体的密度不再不变
D.单位时间内断裂3NA个H—H健同时形成2NA个C=O键
(5)仅改变某个反应条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线I、II所示。曲线Ⅱ对应的实验条件改变是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,能与Fe3+反应,且能证明Fe3+具有氧化性的是( )
①SCN﹣;②Fe;③Fe2+;④Cu;⑤Zn;⑥OH﹣ .
A.①②③
B.②④⑤
C.①③⑥
D.①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g)。平衡常数如下表:下列说法正确的是( )
CH3OH(g)。平衡常数如下表:下列说法正确的是( )
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
A. 该反应的△H> 0
B. 加压、增大H2浓度和加入催化剂都能提高CO的转化率
C. 工业上采用5 ×103 kPa和 250℃的条件,其原因是原料气的转化率高
D. t℃时,向 1 L密闭容器中投入0.1 mol CO和0.2 mol H2,平衡时CO转化率为50%,则该温度时反应的平衡常数的数值为100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的捕集、利用与封存是我国能源领域的一个重要战略方向,发展成一项重要的新兴产业。
(1)已知:CH4、CO、H2的燃烧热分别为890kJmol-1、283kJmol-1、285.8kJmol-1,计算下列反应的反应热。CO2(g)+CH4(g)=2CO(g)+ 2H2(g)ΔH=___________kJmol-1。
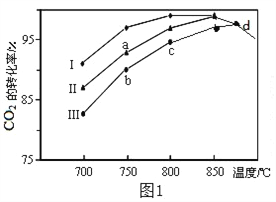
(2)利用废气中的CO2为原料制取甲醇,反应方程式为:CO2+3H2![]() CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示。
CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示。
①该反应的ΔH_____0(填“>”或“<”)
②d点不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下CO2的转化率相同的原因是________。
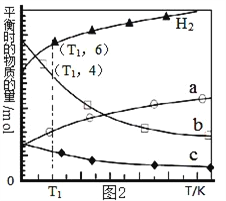
(3)用二氧化碳催化加氢来合成低碳烯烃,起始时以0.1MPa,n(H2)∶n(CO2)=3∶1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图2所示:
C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图2所示:
①该反应在_________自发进行(填“低温”或“高温”)。
②b代表的物质是______________。
③T1温度下的平衡转化率为_________________,相对于起始状态,平衡时气体的平均分子量增大的百分率为______________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来验证元素周期律。
Ⅰ.甲同学用过氧化氢的水溶液和二氧化锰制备氧气,并将其通入氢硫酸中。

(1)过氧化氢的电子式为________________。
(2)从图1中选择氧气的制备装置:________(填“A”或“B”),反应前需要进行的操作是___________。
(3)该实验如何证明O的非金属性强于S?________________________(用化学方程式表示)。
Ⅱ.乙同学利用图3所示实验装置设计实验来验证氮、碳、硅元素的非金属性强弱。已知A是一种强酸溶液,常温下可与铜反应;B是难溶性块状固体;打开分液漏斗的活塞后,可观察到烧杯中有白色沉淀生成。
(4)写出所选物质或溶液中溶质的化学式:A________,B________,C________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com