
【题目】2017年11月联合国气候大会在德国波恩开幕,CO2的回收利用再一次提上了日程。
I利用CO2制取丙烯(C3H6)
(1)用CO2催化加氢可制取丙烯的原理为:3CO2(g)+9H2(g) ![]() C3H6(g)+6H2O(g) △H。
C3H6(g)+6H2O(g) △H。
已知热化学方程式如下
①2C2H6(g)+9O2(g)=6CO2(g)+6H2O(l) △H1;
②2H2O(g)=2H2(g)+O2(g) ΔH2;
③H2O(g)==H2O(l) △H3;
则制取丙烯反应的△H= ______(用△H1、△H2、△H3表示)。
(2)以稀磷酸为电解质溶液,以石墨为电极,利用太阳能电池将CO2转化为丙烯的工作原理如下图所示。
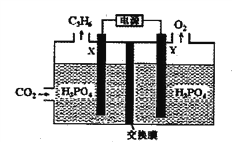
①电解池中的交换膜为_______ :(填“阴”或“阳")离子交换膜,通过交换的离子是_______(填离子符号)。
②阴极的电极反应为_____________________________。
II.利用CO2制取二甲醚(CH3OCH3)
(3)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料
CH3OCH3(g)+3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料
比n(H2)/n(CO2)]的变化曲线如下左图:
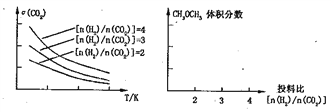
①在其他条件不变时,在右图中画出平衡时CH3OCH3的体积分数随投料比n(H2)/n(CO2)交化的曲线图____________。
②某温度下将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如下图所示,关于温度和压强的关系判断正确的是____________。
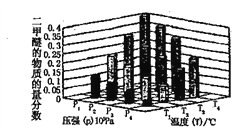
A.P4>P3>P2>P1 B .T4>T3>T2>T1 C.P1>P2>P3>P4 D. T1>T2>T3>T4.
III利用CO2制取甲醇(CH3OH)
用CO2催化加氢制取甲醇的反应为CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-b kJ·mol—1(b>0)。T℃时,将 1 mol CO2和4molH2充入的密闭溶液中,测得H2的物质的量随时间变化如图中实线所示
CH3OH(g)+H2O(g) △H=-b kJ·mol—1(b>0)。T℃时,将 1 mol CO2和4molH2充入的密闭溶液中,测得H2的物质的量随时间变化如图中实线所示
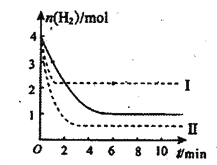
(4)不能证明该反应达到化学平衡状态的是___________。
A.气体的总压强不变
B. CH3 OH(g)和H2O(g)的物质的量之比不变
C.混合气体的密度不再不变
D.单位时间内断裂3NA个H—H健同时形成2NA个C=O键
(5)仅改变某个反应条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线I、II所示。曲线Ⅱ对应的实验条件改变是_____________。
【答案】 3△H3-1/2△H1-9/2△H2 阳 H+ 3CO2+18e—+18H+==C3H6+6H2O ②
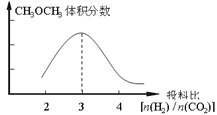 (大致方向正确既可以给分,但与3对应的必须是最高点) CD BC 增大压强(或增大CO2的浓度)
(大致方向正确既可以给分,但与3对应的必须是最高点) CD BC 增大压强(或增大CO2的浓度)
【解析】I(1) ①2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l) △H1;②2H2O(g)=2H2(g)+O2(g) ΔH2;③H2O(g)==H2O(l) △H3。由③![]() ②
②![]() 可得,3CO2(g)+9H2(g)
可得,3CO2(g)+9H2(g) ![]() C3H6(g)+6H2O(g) 所以制取丙烯反应的△H= 3△H3-1/2△H1-9/2△H2。
C3H6(g)+6H2O(g) 所以制取丙烯反应的△H= 3△H3-1/2△H1-9/2△H2。
(2)以稀磷酸为电解质溶液,以石墨为电极,利用太阳能电池将CO2转化为丙烯。由图中信息可知,X为阴极、Y为阳极,阴极的电极反应为3CO2+18e—+18H+==C3H6+6H2O,阳极的电极反应为2H2O-4e-=4H++O2↑,反应过程中阴极要消耗氢离子,氢离子必须向阴极定向移动,所以交换膜为阳离子交换膜。
①电解池中的交换膜为阳离子交换膜,通过交换的离子是H+。
②阴极的电极反应为3CO2+18e—+18H+==C3H6+6H2O。
II.(3)将燃煤废气中的CO2转化为二甲醚的反应原理为2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g)。由图像可知,该反应的二氧化碳的转化率随温度升高而减小,所以该反应为放热反应。
CH3OCH3(g)+3H2O(g)。由图像可知,该反应的二氧化碳的转化率随温度升高而减小,所以该反应为放热反应。
①由化学方程式可知,在其他条件不变时,投料比n(H2)/n(CO2)=3时,平衡时CH3OCH3的体积分数最大,所以平衡时CH3OCH3的体积分数随投料比n(H2)/n(CO2)变化的曲线图为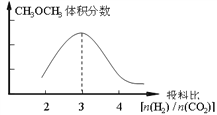 。
。
②某温度下将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中。由题中信息及图像可知,温度越低、压强越大,则二甲醚的百分含量越高,所以T1>T2>T3>T4.、P1>P2>P3>P4,所以关于温度和压强的关系判断正确的是CD。
III用CO2催化加氢制取甲醇的反应为CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
△H=-b kJ·mol—1(b>0),该反应为放热反应。
(4) A.该反应是气体分子数减少的反应,所以当气体的总压强不变,达到平衡状态;B. 从反应开始在反应到达平衡之前,CH3 OH(g)和H2O(g)的物质的量之比一直不变,所以CH3 OH(g)和H2O(g)的物质的量之比不变时,不一定是平衡状态;C.混合气体的密度一直不变,所以无法根据密度判断平衡状态;D.单位时间内断裂3NA个H—H健同时形成2NA个C=O键,说明正反应速率和逆反应速率相等,达到平衡状态。总之,不能证明该反应达到化学平衡状态的是BC。
(5)由曲线Ⅱ可知,改变条件后,不仅化学反应速率加快了,而且平衡也向正反应方向移动了,所以对应的实验条件改变是增大压强(或增大CO2的浓度),不可能是升高温度(因为正反应为放热反应)。


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】室温下,将1 mol Na2CO3·10H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1 mol Na2 CO3(s)溶于水会使溶液温度升高,热效应为△H2;Na2CO3·10H2O受热分解的化学方程式为Na2CO3·10H2O (s) ![]() Na2CO3(s)+10H2O(1),热效应为△H3。则下列判断正确的是( )
Na2CO3(s)+10H2O(1),热效应为△H3。则下列判断正确的是( )
A.△H2 <△H3 B.△H1>△H3 C.△Hl+△H3=△H2 D.△H1+△H2>△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国预计在2020年前后建成自己的载人空间站。为了实现空间站的零排放,循环利用人体呼出的CO2并提供O2,我国科学家设计了一种装置(如下图),实现了“太阳能一电能一化学能”转化,总反应方程式为2CO2=2CO+O2 。关于该装置的下列说法不正确的是

装置a 装置b
附:⊕表示阳离子,Θ表示阴离子
A. 装置a将太阳能转化为电能,装置b将电能转化为化学能
B. 工作过程中OH-向Y电极周围移动
C. 人体呼出的气体参与X电极的反应:CO2+2e-+H2O=CO+2OH-
D. 反应完毕后恢复到原温度,装置b中电解质溶液的碱性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,反应A2(g)+B2(g)![]() 2AB(g)达到限度的标志是( )
2AB(g)达到限度的标志是( )
A. 单位时间内生成n mol A2同时生成n mol AB
B. 容器内的总物质的量不随时间变化
C. 单位时间内生成2n mol AB的同时生成n mol B2
D. 单位时间内生成n mol A2的同时生成n mol B2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.某微粒核外电子排布为2、8、8结构,则该微粒一定是氩原子
B.最外层电子达稳定结构的微粒只能是稀有气体的原子
C.NH4+与OH-具有相同的质子数和电子数
D.F-、Na+、Mg2+、Al3+是与Ne原子具有相同电子层结构的离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,VL pH=2的盐酸与0.2L pH=12的氨水混合,若所得溶液显酸性,下列有关判断正确的是( )
A. V一定等于0.2
B. V大于或等于0.2
C. 混合溶液中离子浓度一定满足:c(Cl-)>c(NH![]() )> c(H+)>c(OH-)
)> c(H+)>c(OH-)
D. 混合溶液中离子浓度一定满足:c(NH![]() )+c(H+)= c(Cl-)+c(OH-)
)+c(H+)= c(Cl-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列五种溶液:
① 0.1mol/L NH4Cl
② 0.1mol/L CH3COONH4
③ 0.1mol/L NH4HSO4
④ 0.1mol/L NH3·H2O和0.1mol/L NH4Cl的混合液
请根据要求填写下列空白:
(1)溶液①呈酸性,其原因是__________________________________(用离子方程式表示)
(2)比较溶液②、③中c(NH4+)的大小关系是②____③(填“>”“=”或“<”)。
(3)在溶液④中,_________离子的浓度为0.1mol/L;NH3·H2O和 ___________离子的浓度之和为0.2 mol/L。
(4)室温下,测得溶液②的pH=7, CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)______c(NH4+)(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)可用作有机化学的氯化剂,在药物和染料的制取中也有重要作用。某化学学习小组拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯。反应的化学方程式为:SO2(g)+ Cl2(g) =SO2Cl2(l) ΔH =97.3 kJ·mol1,实验装置如图所示(部分夹持装置未画出)。
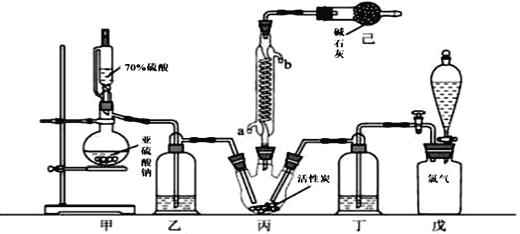
已知:硫酰氯通常条件下为无色液体,熔点54.1℃,沸点69.1℃。在潮湿空气中“发烟”;100°C以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
回答下列问题:
(1)装置甲中作为反应容器的仪器的名称为________,装置己的作用是________;如何控制两种反应物体积相等:________。
(2)装置戊上方分液漏斗中最好选用下列试剂:(_______)(选填字母)。
A.蒸馏水 B.饱和食盐水 C.浓氢氧化钠溶液 D.6.0 molL1盐酸
(3)若缺少装置乙和丁(均盛放浓硫酸),潮湿氯气和二氧化硫发生反应的化学方程式是________________________________________。
(4)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯:2ClSO3H =SO2Cl2 + H2SO4,分离两种产物的方法是(_______) (选填字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(5)长期储存的硫酰氯会发黄,可能的原因是________ (用化学方程式和必要的文字加以解释)。
(6)若反应中消耗的氯气体积为896 mL(标准状况下),最后经过分离提纯得到4.05 g纯净的硫酰氯,则硫酰氯的产率为________。为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有________________ ________________________________________ (写两条即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com