
【题目】下列说法正确的是
A.某微粒核外电子排布为2、8、8结构,则该微粒一定是氩原子
B.最外层电子达稳定结构的微粒只能是稀有气体的原子
C.NH4+与OH-具有相同的质子数和电子数
D.F-、Na+、Mg2+、Al3+是与Ne原子具有相同电子层结构的离子
科目:高中化学 来源: 题型:
【题目】在工业上常用CO和H2合成甲醇,反应方程式为:
CO(g)+2H2(g)![]() CH3OH(g) △H = akJ/mol
CH3OH(g) △H = akJ/mol
已知:①CO(g)+1/2O2(g)= CO2(g) △H1=﹣283.0kJ/mol
②H2(g)+1/2O2(g)= H2O(g) △H2=﹣241.8kJ/mol
③CH3OH(g)+3/2O2(g)= CO2(g)+ 2H2O(g)△H3=﹣192.2kJ/mol
回答下列问题:
(1)a = _______
(2)能说明反应CO(g)+2H2(g)![]() CH3OH(g)已达平衡状态的是___(填字母)。
CH3OH(g)已达平衡状态的是___(填字母)。
A.单位时间内生成1mol CH3OH(g)的同时消耗了1mol CO(g)
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,气体的平均摩尔质量不再变化
(3)在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与![]() 的关系如图1所示.
的关系如图1所示.
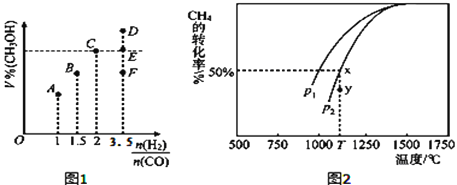
①当起始![]() =2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=_____________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将____________(选填“增大”、“减小”或“不变”);
=2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=_____________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将____________(选填“增大”、“减小”或“不变”);
②当![]() = 3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的_______点(选填“D”、“E”或“F”)。
= 3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的_______点(选填“D”、“E”或“F”)。
(4)CO和H2来自于天然气。已知CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1molL﹣1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强p1_____p2(选填“大于”或“小于”);当压强为p2时,在y点:v(正)______v(逆)(选填“大于”、“小于”或“等于”)。若p2=3MPa,则T℃时该反应的平衡常数Kp=_______MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1molL﹣1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强p1_____p2(选填“大于”或“小于”);当压强为p2时,在y点:v(正)______v(逆)(选填“大于”、“小于”或“等于”)。若p2=3MPa,则T℃时该反应的平衡常数Kp=_______MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列比例模型,每个模型表示的分子均由C、H、O中的两种或三种构成。对各模型表示的物质的相关叙述正确的是( )
比例模型 | 对模型表示的物质的相关叙述 | |
A |
| 将形状、大小均相同的金属钠分别投入盛有0.1 mol/L的该物质的水溶液、无水乙醇和水的烧杯中,盛该物质的烧杯中产生气泡的速率最慢 |
B |
| 将灼热的铜丝反复插入盛有该物质的试管中,观察到铜丝由黑色变为光亮的红色并产生有刺激性气味的物质。此反应体现了该物质的氧化性 |
C |
| 在分液漏斗中加入该物质与碘水的混合液,充分振荡,碘水褪色,此时发生了取代反应 |
D |
| 该物质及其碳原子数小于10的同系物中,一氯代物只有一种(不考虑立体异构)的物质共有4种 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①甲烷、②乙烯、③苯、④乙酸、⑤葡萄糖5种有机物,请用序号或按题中要求作答:
(1)分子中所有原子一定都共面的是________。
(2)含氢量最高的有机化合物是________,其电子式为________。
(3)完全燃烧后生成的CO2和水的物质的量之比为1∶1的化合物是________。
(4)其中含有两种不同官能团的有机物是________,官能团的名称分别为________和________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年11月联合国气候大会在德国波恩开幕,CO2的回收利用再一次提上了日程。
I利用CO2制取丙烯(C3H6)
(1)用CO2催化加氢可制取丙烯的原理为:3CO2(g)+9H2(g) ![]() C3H6(g)+6H2O(g) △H。
C3H6(g)+6H2O(g) △H。
已知热化学方程式如下
①2C2H6(g)+9O2(g)=6CO2(g)+6H2O(l) △H1;
②2H2O(g)=2H2(g)+O2(g) ΔH2;
③H2O(g)==H2O(l) △H3;
则制取丙烯反应的△H= ______(用△H1、△H2、△H3表示)。
(2)以稀磷酸为电解质溶液,以石墨为电极,利用太阳能电池将CO2转化为丙烯的工作原理如下图所示。
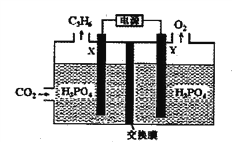
①电解池中的交换膜为_______ :(填“阴”或“阳")离子交换膜,通过交换的离子是_______(填离子符号)。
②阴极的电极反应为_____________________________。
II.利用CO2制取二甲醚(CH3OCH3)
(3)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料
CH3OCH3(g)+3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料
比n(H2)/n(CO2)]的变化曲线如下左图:
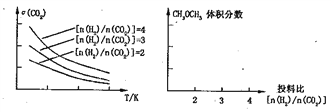
①在其他条件不变时,在右图中画出平衡时CH3OCH3的体积分数随投料比n(H2)/n(CO2)交化的曲线图____________。
②某温度下将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如下图所示,关于温度和压强的关系判断正确的是____________。
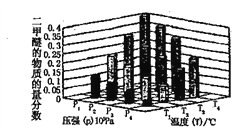
A.P4>P3>P2>P1 B .T4>T3>T2>T1 C.P1>P2>P3>P4 D. T1>T2>T3>T4.
III利用CO2制取甲醇(CH3OH)
用CO2催化加氢制取甲醇的反应为CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-b kJ·mol—1(b>0)。T℃时,将 1 mol CO2和4molH2充入的密闭溶液中,测得H2的物质的量随时间变化如图中实线所示
CH3OH(g)+H2O(g) △H=-b kJ·mol—1(b>0)。T℃时,将 1 mol CO2和4molH2充入的密闭溶液中,测得H2的物质的量随时间变化如图中实线所示
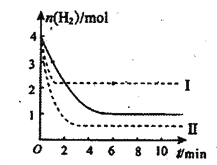
(4)不能证明该反应达到化学平衡状态的是___________。
A.气体的总压强不变
B. CH3 OH(g)和H2O(g)的物质的量之比不变
C.混合气体的密度不再不变
D.单位时间内断裂3NA个H—H健同时形成2NA个C=O键
(5)仅改变某个反应条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线I、II所示。曲线Ⅱ对应的实验条件改变是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3·H2O![]() NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)
增大,应加入的物质或采取的措施是
①NH4Cl固体,②硫酸,③NaOH固体,④水,⑤加热,⑥加入少量MgSO4固体
A、①②③⑤ B、③ C、③⑥ D、③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是( )
①标准状况下,11.2 L以任意比例混合的氮气和氧气所含的原子数为NA
②同温同压下,体积相同的氢气和氩气所含的分子数相等
③1 L 2 mol·L-1的AlCl3溶液中含氯离子为6NA
④标准状况下,22.4 L H2O中分子数为NA
⑤32 g O2和O3混合气体中含有原子数为2NA
A. ①②③⑤ B. ①②③④
C. ①③④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。在如图所示的物质转化关系中,p、q、m、n分别是元素W、X、Y、Z的气体单质,p和s均为有色气体,v的水溶液呈碱性。常温下,0.1 molL-1 t溶液与0.1 molL-1 u溶液的pH 均为1。下列说法不正确的是
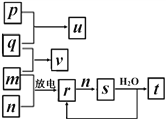
A. Y、W的最高价氧化物对应的水化物均为强酸
B. 元素的非金属性:Z>Y>X,原子半径:X<Z<Y
C. s溶于水的反应中,氧化剂与还原剂的物质的量之比为1:2
D. v的电子式可表示为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com