
【题目】在工业上常用CO和H2合成甲醇,反应方程式为:
CO(g)+2H2(g)![]() CH3OH(g) △H = akJ/mol
CH3OH(g) △H = akJ/mol
已知:①CO(g)+1/2O2(g)= CO2(g) △H1=﹣283.0kJ/mol
②H2(g)+1/2O2(g)= H2O(g) △H2=﹣241.8kJ/mol
③CH3OH(g)+3/2O2(g)= CO2(g)+ 2H2O(g)△H3=﹣192.2kJ/mol
回答下列问题:
(1)a = _______
(2)能说明反应CO(g)+2H2(g)![]() CH3OH(g)已达平衡状态的是___(填字母)。
CH3OH(g)已达平衡状态的是___(填字母)。
A.单位时间内生成1mol CH3OH(g)的同时消耗了1mol CO(g)
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,气体的平均摩尔质量不再变化
(3)在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与![]() 的关系如图1所示.
的关系如图1所示.
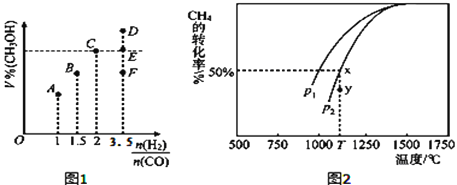
①当起始![]() =2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=_____________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将____________(选填“增大”、“减小”或“不变”);
=2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=_____________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将____________(选填“增大”、“减小”或“不变”);
②当![]() = 3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的_______点(选填“D”、“E”或“F”)。
= 3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的_______点(选填“D”、“E”或“F”)。
(4)CO和H2来自于天然气。已知CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1molL﹣1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强p1_____p2(选填“大于”或“小于”);当压强为p2时,在y点:v(正)______v(逆)(选填“大于”、“小于”或“等于”)。若p2=3MPa,则T℃时该反应的平衡常数Kp=_______MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1molL﹣1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强p1_____p2(选填“大于”或“小于”);当压强为p2时,在y点:v(正)______v(逆)(选填“大于”、“小于”或“等于”)。若p2=3MPa,则T℃时该反应的平衡常数Kp=_______MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
【答案】 a =﹣574.4 C D 0.12mol/(L·min) 增大 F 小于 大于 4
【解析】(1). 已知反应①CO(g)+1/2O2(g)= CO2(g) △H1=﹣283.0kJ/mol
②H2(g)+1/2O2(g)= H2O(g) △H2=﹣241.8kJ/mol
③CH3OH(g)+3/2O2(g)= CO2(g)+ 2H2O(g)△H3=﹣192.2kJ/mol,
根据盖斯定律可知,①+②×2③可得:CO(g)+2H2(g)![]() CH3OH(g),则△H=akJ/mol=(283.0kJ/mol)+(241.8kJ/mol)×2(192.2kJ/mol)=574.4kJ/mol,即a=574.4,故答案为:574.4;
CH3OH(g),则△H=akJ/mol=(283.0kJ/mol)+(241.8kJ/mol)×2(192.2kJ/mol)=574.4kJ/mol,即a=574.4,故答案为:574.4;
(2). A. 根据反应方程式可知,单位时间内生成1molCH3OH(g)时,一定会消耗1molCO(g),所以不能说明反应达到平衡标志,故A错误;B. 由于此反应全部是气体参与和生成的反应,故反应体系中气体的质量不变,在恒温恒容的容器中,容器的体积不变,则混合气体的密度始终不变,所以不能说明反应达到平衡状态,故B错误;C. 在绝热恒容的容器中,反应的平衡常数不再变化,说明容器的温度已不再变化,所以反应达到了平衡状态,故C正确;D. 此反应是气体物质的量减小的反应,因气体的总质量不变,则气体的平均摩尔质量不变时,反应达到平衡状态,故D正确;答案选:CD;
(3). ①. H2和CO总共为3mol,起始时n(H2):n(CO)=2,则H2为2mol、CO为1mol,5min达到平衡时CO的转化率为0.6,则:
CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
起始(mol): 1 2 0
转化(mol): 0.6 1.2 0.6
平衡(mol): 0.4 0.8 0.6
容器的容积为2L,则v(H2)=1.2mol÷2L÷5min=0.12mol/( L·min);该温度下平衡常数K=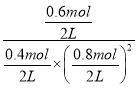 =9.375,此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,此时浓度商Qc=
=9.375,此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,此时浓度商Qc=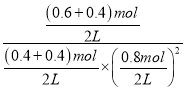 =7.81<K,则反应向正反应方向进行,达新平衡时H2的转化率将增大,
=7.81<K,则反应向正反应方向进行,达新平衡时H2的转化率将增大,
故答案为:0.12mol/( L·min);增大;
②. 混合比例等于化学计量数之比时,平衡时生成物的含量最大,故当![]() = 3.5时,达到平衡状态后,CH3OH的体积分数小于C点,则CH3OH的体积分数可能是图象中的F点,故答案为:F;
= 3.5时,达到平衡状态后,CH3OH的体积分数小于C点,则CH3OH的体积分数可能是图象中的F点,故答案为:F;
(4). CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)的正反应为气体物质的量增大的反应,较低的压强有利于反应正向进行,压强越大平衡时甲烷的转化率越小,则压强p1<p2;当压强为p2时,在y点甲烷的转化率小于平衡时(x点)的转化率,反应未达到平衡,则反应正向进行到达平衡,则在y点:v(正)>v(逆);若p2=3MPa,x点甲烷转化率为50%,则:
2CO(g)+2H2(g)的正反应为气体物质的量增大的反应,较低的压强有利于反应正向进行,压强越大平衡时甲烷的转化率越小,则压强p1<p2;当压强为p2时,在y点甲烷的转化率小于平衡时(x点)的转化率,反应未达到平衡,则反应正向进行到达平衡,则在y点:v(正)>v(逆);若p2=3MPa,x点甲烷转化率为50%,则:
CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
起始浓度(mol/L): 0.1 0.1 0 0
变化浓度(mol/L): 0.05 0.05 0.1 0.1
平衡浓度(molL): 0.05 0.05 0.1 0.1
平衡常数Kp=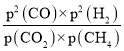 =
= 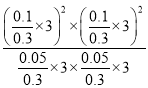 (MPa)2=4(MPa)2,故答案为:小于;大于;4。
(MPa)2=4(MPa)2,故答案为:小于;大于;4。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。
N2(g)+CO2(g)。
(1)写出上述反应的平衡常数表达式_______________。
(2)在2L恒容密闭器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
①结合表中数据,判断该反应的△H____0(填“>”或“<”),理由是_________。
②判断该反应达到平衡的依据是_______。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)= v逆(N2)
(3)700℃时,若向2L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g)![]() C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。

①0~10 min内的CO2平均反应速率v=____________。
②图中A点v(正)___v(逆)(填“>”、“<”或“=”)。
③第10 min时,外界改变的条件可能是_____________。
A.加催化剂 B.增大C的物质的量
C.减小CO2的物质的量 D.升温 E.降温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是新型氢氧燃料电池,则下列说法中不正确的是( )
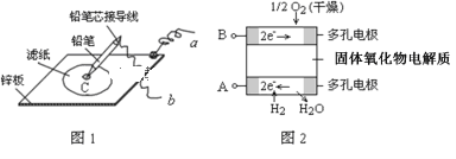
A. 图2电池放电过程中,O2﹣从B极区向A极区迁移
B. 图2电池负极区的电极反应为H2﹣2e﹣+O2﹣=H2O
C. 若用氯化钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则铅笔芯C点先变红后褪色
D. 图1的铅笔为正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α1和α2分别为A、B在两个恒容容器中平衡体系A(g)![]() 2B(g)和2A(g)
2B(g)和2A(g)![]() B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是
B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是
A. α1、α2均减小 B. α1、α2均增大
C. α1减小,α2增大 D. α1增大,α2减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁制品容易生锈,对钢铁制品防腐措施合理的是
A. 暂时不使用的铁锅涂上油 B. 铁质自来水管缠上铜线
C. 铜铁帽的防护栏涂上油漆 D. 自行车钢圈镀铬
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为__________mol·L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是________(填字母)。
A.溶液中HCl的物质的量
B.溶液的浓度
C.溶液中Cl-的数目
D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取________mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面(____)
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水(____)
(4)①假设该同学成功配制了0.400 mol·L-1的盐酸,他又用该盐酸中和含0.4 g NaOH的NaOH溶液,则该同学需取________mL盐酸。
②假设该同学用新配制的盐酸中和含0.4 g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是________。(填字母)
A.浓盐酸挥发,浓度不足
B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.某微粒核外电子排布为2、8、8结构,则该微粒一定是氩原子
B.最外层电子达稳定结构的微粒只能是稀有气体的原子
C.NH4+与OH-具有相同的质子数和电子数
D.F-、Na+、Mg2+、Al3+是与Ne原子具有相同电子层结构的离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com