
【题目】用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。
N2(g)+CO2(g)。
(1)写出上述反应的平衡常数表达式_______________。
(2)在2L恒容密闭器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
①结合表中数据,判断该反应的△H____0(填“>”或“<”),理由是_________。
②判断该反应达到平衡的依据是_______。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)= v逆(N2)
(3)700℃时,若向2L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g)![]() C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。

①0~10 min内的CO2平均反应速率v=____________。
②图中A点v(正)___v(逆)(填“>”、“<”或“=”)。
③第10 min时,外界改变的条件可能是_____________。
A.加催化剂 B.增大C的物质的量
C.减小CO2的物质的量 D.升温 E.降温
【答案】 ![]() > 计算700℃和800℃的平衡常数K1<K2,所以△H >0 AB 0.01 mol·L-1·min-1 > AD
> 计算700℃和800℃的平衡常数K1<K2,所以△H >0 AB 0.01 mol·L-1·min-1 > AD
【解析】K=![]()
(2)①根据表格数据,列出实验1(700℃)的三段式:
C(s)+2NO(g)N2(g)+CO2(g)
起始物质的量/mol 0.4 0 0
变化物质的量/mol 0.18 0.09 0.09
平衡物质的量/mol 0.22 0.09 0.09
K1=![]() =
=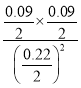 =
=![]() ,
,
据表格数据,列出实验2(℃)的三段式:
C(s)+2NO(g)N2(g)+CO2(g)
起始物质的量/mol 0.24 0 0
变化物质的量/mol 0.16 0.08 0.08
平衡物质的量/mol 0.08 0.08 0.08
K2=![]() =
=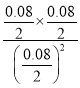 =1>K1;
=1>K1;
温度升高,K增大,则正反应为吸热反应,△H>0。
故答案为:>;700℃和800℃的平衡常数K1<K2,所以△H >0。
②A、该反应气体的总质量是个变量,容器体积不变,所以密度是一个变量,当容器内气体密度恒定时,则反应达到平衡状态,故A正确;B、各组分的浓度不再改变能说明反应达到平衡状态,故B正确;C、该反应前后气体分子的数目相同,则气体的总物质的量一直不变,根据pV=nRT,恒温恒容条件下,压强一直不变,所以容器内压强恒定不能说明反应达到平衡状态,故C错误;D、2v正(NO)= v逆(N2)错误,此时正反应速率和逆反应速率不相等,应是v正(NO)= 2v逆(N2)时反应达到平衡状态故D错误。故选AB。
故答案为:AB。
③①随着反应进行,n(N2)逐渐减小,n(NO)逐渐增大,10min内,△n(N2)=0.2mol,物质的量变化之比等于计量系数之比,则△n(CO2)=0.2mol,所以v(CO2)= ![]() =0.01 mol·L-1·min-1;
=0.01 mol·L-1·min-1;
②根据图像可知A点反应向正反应方向进行,则v(正)>v(逆),故答案为:>;
③第10min时,N2、NO物质的量没有发生突变,N2的物质的量逐渐减小,速率比10min前大;NO物质的量逐渐增大,速率比10min前大。A、加催化剂,不会引起物质的量的突变,只会增大反应速率,故A正确;B、增大碳固体的物质的量,对反应速率没有影响,故B错误;C、减小CO2的物质的量,反应速率减小,故C错误;D、升温,反应速率增大,故D正确;E、降温,反应速率减小,故E错误。故选AD。


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中,肯定能说明金属甲比金属乙金属性强的是( )
A.甲原子最外层电子数比乙原子最外层电子数少
B.甲原子电子层数比乙原子电子层数多
C.1mol甲从酸中置换生成的氢气比1mol乙从酸中置换生成的氢气多
D.常温下,甲能与水反应生成氢气,而乙不能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:
方法Ⅰ | 用炭粉在高温条件下还原CuO |
方法Ⅱ | 电解法的反应为2Cu+H2O |
(1)已知:2Cu(s) + 1/2 O2(g) = Cu2O(s) △H = -169KJ/mol
C(s) +1/2 O2(g) = CO(g) △H= -110.5kJ/mol
Cu(s) + 1/2 O2(g) = CuO(s) △H = -157kJ/mol
则方法Ⅰ反应的热化学方程式为______________________ 。
(2)方法Ⅱ采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中c(OH-)制备纳米Cu2O,其装置如图甲、乙。


图甲 图乙
①上述装置中D电极应连接肼燃料电池的_______极(填“A”或“B”),该电解池中离子交换膜为______离子交换膜(填“阴”或“阳”)。
②该电解池的阳极反应式为_______________________________,肼燃料电池中A极发生的电极反应为___________________________________。
③当反应生成14.4 g Cu2O时,至少需要肼______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸(HNO2)为一元弱酸,其性质与硝酸相似。已知:298K时,四种物质的电离平衡常数(K)如下表。
HNO2 | NH3·H2O | H2CO3 | H2SO3 | |
K(mol·L-1)-2 | 5.1×10-4 | 1.8×10-5 | Ka1=4.2×10-7 Ka2=5.61×10-11 | Ka1=1.3×10﹣2 Ka2=6.3×10﹣8 |
(1)下列不能说明HNO2是弱电解质的是_____。
A.常温下0.1 mol·L-1 NaNO2溶液的pH>7
B.用一定浓度HNO2溶液做导电实验,灯泡很暗
C.等pH、等体积的盐酸和HNO2溶液分别与足量锌反应,HNO2放出的氢气较多
D.常温下,0.1mol·L-1 HNO2溶液的pH=2.3
(2)298K时,将10mL 0.1mol·L-1的亚硝酸溶液与10mL 0.1mol·L-1氨水混合,所得溶液为_____(填“酸性”、“碱性”或“中性”),原因是___________________________。
(3)若将pH=2的HNO2、HCl两溶液分别加水稀释,pH变化如右图所示,判断曲线I对应的溶液为_______(填化学式)。图中a、b、c三点对应溶液的导电能力由强到弱的顺序是
________(用a、b、c表示,下同);溶液中水的电离程度由强到弱的顺序是________。

(4)依据提供数据回答下列问题。
①求298K时,NaHSO3溶液中HSO3-水解平衡常数Kh =____;由此可判断HSO3-水解程度______电离程度(填“>”、“<”或“=”)。
②H 2SO3溶液和NaHCO3溶液反应的主要离子方程式为______。
(5)298K时,向含有2mol Na2CO3的溶液中加入1mol的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水四氯化锡是无色易流动的液体。熔点-33℃,沸点114.1℃。遇潮湿空气,水解而生成锡酸和氯化氢。下图是实验室制备无水四氯化锡并对产品蒸馏,制得纯净无水氧化锡的实验设计(加热及夹持装置已略去)。
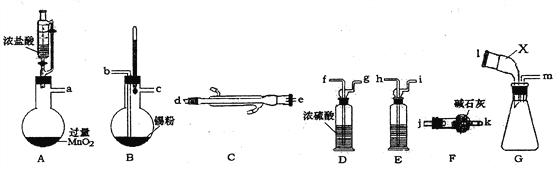
(1)装置A中反生反应的离子方程式_______________________。
(2)上述实验仪器口连接顺序为__________________________________。
(3)装置E中盛装试剂的名称为_________;上述实验正确的操作顺序为_____________。
①点燃装置A处酒精灯;②点燃装置B处酒精灯;③打开恒压漏斗活塞。
(4)装置G中仪器X的名称为___________。装置F的作用为_________________。
(5)将四氯化锡慢慢加水生成SnO2胶体和六氯合锡酸[H2[SnC16]],该反应的化学反应方程式为______________________。
(6)设计实验测定盐酸与MnO2反应的最低浓度,进行了如下操作:
I将装置A中液体加热至不再产生黄绿色气体为止,冷却过滤。
Ⅱ取上述滤液10mL稀释到400mL
III取稀释后溶液25.00mL加入指示剂进行滴定,滴定终点消耗0.2mol ·L-1的NaOH溶液19.25mL。
①上述条件下Mn2+开始沉淀的pH为5.2,则滴定时最好选用的指示剂为_____________。
②通过上述数据计算,盐酸与MnO2反应的最低浓度为__________(结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年国产大飞机C919试飞成功,飞机上使用了碳纤维复合材料。下列物质属于复合材料的是( )
A. 玻璃钢
B. 尼龙
C. 聚氯乙烯
D. 镁铝合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式见图,下列说法正确的是( )
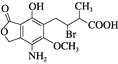
A. 分子式为C14H16O6NBr
B. 该分子中含有两个手性碳原子
C. 不能使酸性高锰酸钾溶液褪色
D. 在一定条件下与氢氧化钠溶液反应,1 mol该有机物最多消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在工业上常用CO和H2合成甲醇,反应方程式为:
CO(g)+2H2(g)![]() CH3OH(g) △H = akJ/mol
CH3OH(g) △H = akJ/mol
已知:①CO(g)+1/2O2(g)= CO2(g) △H1=﹣283.0kJ/mol
②H2(g)+1/2O2(g)= H2O(g) △H2=﹣241.8kJ/mol
③CH3OH(g)+3/2O2(g)= CO2(g)+ 2H2O(g)△H3=﹣192.2kJ/mol
回答下列问题:
(1)a = _______
(2)能说明反应CO(g)+2H2(g)![]() CH3OH(g)已达平衡状态的是___(填字母)。
CH3OH(g)已达平衡状态的是___(填字母)。
A.单位时间内生成1mol CH3OH(g)的同时消耗了1mol CO(g)
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,气体的平均摩尔质量不再变化
(3)在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与![]() 的关系如图1所示.
的关系如图1所示.
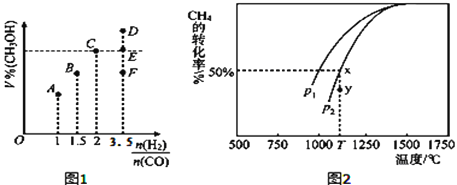
①当起始![]() =2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=_____________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将____________(选填“增大”、“减小”或“不变”);
=2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=_____________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将____________(选填“增大”、“减小”或“不变”);
②当![]() = 3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的_______点(选填“D”、“E”或“F”)。
= 3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的_______点(选填“D”、“E”或“F”)。
(4)CO和H2来自于天然气。已知CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1molL﹣1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强p1_____p2(选填“大于”或“小于”);当压强为p2时,在y点:v(正)______v(逆)(选填“大于”、“小于”或“等于”)。若p2=3MPa,则T℃时该反应的平衡常数Kp=_______MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1molL﹣1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强p1_____p2(选填“大于”或“小于”);当压强为p2时,在y点:v(正)______v(逆)(选填“大于”、“小于”或“等于”)。若p2=3MPa,则T℃时该反应的平衡常数Kp=_______MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com