
【题目】某有机物的结构简式见图,下列说法正确的是( )
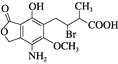
A. 分子式为C14H16O6NBr
B. 该分子中含有两个手性碳原子
C. 不能使酸性高锰酸钾溶液褪色
D. 在一定条件下与氢氧化钠溶液反应,1 mol该有机物最多消耗3 mol NaOH
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)―→C(g) ΔH,分两步进行:①A(g)+B(g)―→X(g) ΔH1;
②X(g)―→C(g) ΔH2。反应过程中能量变化如图1所示,E1表示A+B―→X的活化能,下列说法正确的是

A. ΔH1=ΔH-ΔH2>0
B. X是反应A(g)+B(g)―→C(g)的催化剂
C. E2是反应②的活化能
D. ΔH=E1-E2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。
N2(g)+CO2(g)。
(1)写出上述反应的平衡常数表达式_______________。
(2)在2L恒容密闭器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
①结合表中数据,判断该反应的△H____0(填“>”或“<”),理由是_________。
②判断该反应达到平衡的依据是_______。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)= v逆(N2)
(3)700℃时,若向2L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g)![]() C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。

①0~10 min内的CO2平均反应速率v=____________。
②图中A点v(正)___v(逆)(填“>”、“<”或“=”)。
③第10 min时,外界改变的条件可能是_____________。
A.加催化剂 B.增大C的物质的量
C.减小CO2的物质的量 D.升温 E.降温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g) △H=-566kJ/mol Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g) △H=-226kJ/mol。根据以上热化学方程式判断,下列说法正确的是( )

A. CO的燃烧热为566kJ/mol
B. 上图可表示由CO生成CO2的反应过程和能量关系
C. 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) △H>-452kJ/mol
D. CO2 (g)与Na2O2(s)反应放出452kJ热量时,转移电子个数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是以甲烷和O2构成的燃料电池电解AlCl3溶液的装置,电极材料均为石墨。用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀。下列说法正确的是( )
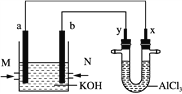
A. 原电池中电解质溶液的pH增大
B. 电解池中电解AlCl3溶液的总反应为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C. M处通入的气体为CH4,电极反应式为CH4+10OH--8e-===CO![]() +7H2O
+7H2O
D. 电解池中Cl-向x极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法不属于污水处理方法的是( )
A. 用蒸馏法制备纯净水
B. 用混凝法除去水中悬浮物颗粒
C. 用熟石灰处理电镀厂产生的酸性水
D. 用沉淀法除去水中的重金属离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是新型氢氧燃料电池,则下列说法中不正确的是( )
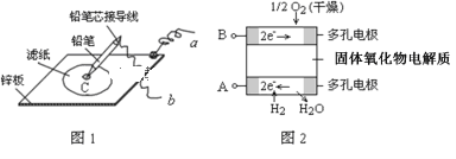
A. 图2电池放电过程中,O2﹣从B极区向A极区迁移
B. 图2电池负极区的电极反应为H2﹣2e﹣+O2﹣=H2O
C. 若用氯化钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则铅笔芯C点先变红后褪色
D. 图1的铅笔为正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α1和α2分别为A、B在两个恒容容器中平衡体系A(g)![]() 2B(g)和2A(g)
2B(g)和2A(g)![]() B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是
B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是
A. α1、α2均减小 B. α1、α2均增大
C. α1减小,α2增大 D. α1增大,α2减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为__________mol·L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是________(填字母)。
A.溶液中HCl的物质的量
B.溶液的浓度
C.溶液中Cl-的数目
D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取________mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面(____)
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水(____)
(4)①假设该同学成功配制了0.400 mol·L-1的盐酸,他又用该盐酸中和含0.4 g NaOH的NaOH溶液,则该同学需取________mL盐酸。
②假设该同学用新配制的盐酸中和含0.4 g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是________。(填字母)
A.浓盐酸挥发,浓度不足
B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com