
【题目】下列互为同分异构体的是
A.12C和14CB.甲烷与戊烷
C.金刚石和石墨D.乙醇和二甲醚[CH3OCH3]
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】无水四氯化锡是无色易流动的液体。熔点-33℃,沸点114.1℃。遇潮湿空气,水解而生成锡酸和氯化氢。下图是实验室制备无水四氯化锡并对产品蒸馏,制得纯净无水氧化锡的实验设计(加热及夹持装置已略去)。
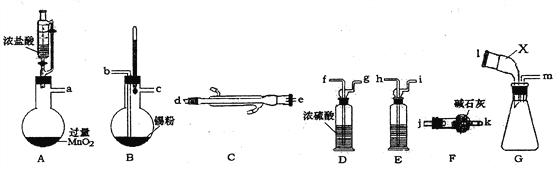
(1)装置A中反生反应的离子方程式_______________________。
(2)上述实验仪器口连接顺序为__________________________________。
(3)装置E中盛装试剂的名称为_________;上述实验正确的操作顺序为_____________。
①点燃装置A处酒精灯;②点燃装置B处酒精灯;③打开恒压漏斗活塞。
(4)装置G中仪器X的名称为___________。装置F的作用为_________________。
(5)将四氯化锡慢慢加水生成SnO2胶体和六氯合锡酸[H2[SnC16]],该反应的化学反应方程式为______________________。
(6)设计实验测定盐酸与MnO2反应的最低浓度,进行了如下操作:
I将装置A中液体加热至不再产生黄绿色气体为止,冷却过滤。
Ⅱ取上述滤液10mL稀释到400mL
III取稀释后溶液25.00mL加入指示剂进行滴定,滴定终点消耗0.2mol ·L-1的NaOH溶液19.25mL。
①上述条件下Mn2+开始沉淀的pH为5.2,则滴定时最好选用的指示剂为_____________。
②通过上述数据计算,盐酸与MnO2反应的最低浓度为__________(结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种香豆素衍生物,可以用作香料,其合成路线如下:

已知:
(1)A所含官能团的名称是___________。
(2)B生成C反应的化学方程式是___________________________________________。
(3)G的结构简式是____________________。
(4)F的结构简式是 。D的分子式是C7H8O,与F互为同系物。D的结构简式是________。
。D的分子式是C7H8O,与F互为同系物。D的结构简式是________。
(5)X的分子式是C13H14O2,X与足量NaOH溶液共热的化学方程式是________________。
(6)E可以经多步反应合成F,请写出一条可能的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取氧化钴的流程如下:
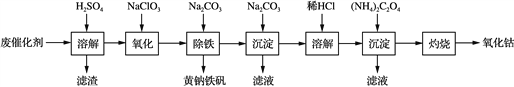
(1) 溶解:溶解后过滤,将滤渣洗涤2~3次,再将洗液与滤液合并的目的是________________________________________________________________________。
(2) 氧化:加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式是____________________________。
已知:铁氰化钾化学式为K3[Fe(CN)6];亚铁氰化钾化学式为K4[Fe(CN)6]·3H2O。
3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4-===Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是__________________________________。(可供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(3) 除铁:加入适量的Na2CO3调节酸度,生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式:_____________________________________________________。
(4) 沉淀:生成沉淀碱式碳酸钴[(CoCO3)2·3Co(OH)2],沉淀需洗涤,洗涤的操作是________________________________________________________________________。
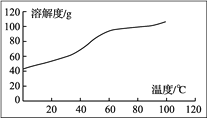
(5) 溶解:CoCl2的溶解度曲线如图所示。向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌至完全溶解后,需趁热过滤,其原因是__________________________________________。
(6) 灼烧:准确称取CoC2O4 1.470 g,在空气中充分灼烧得0.830 g氧化钴,写出氧化钴的化学式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在工业上常用CO和H2合成甲醇,反应方程式为:
CO(g)+2H2(g)![]() CH3OH(g) △H = akJ/mol
CH3OH(g) △H = akJ/mol
已知:①CO(g)+1/2O2(g)= CO2(g) △H1=﹣283.0kJ/mol
②H2(g)+1/2O2(g)= H2O(g) △H2=﹣241.8kJ/mol
③CH3OH(g)+3/2O2(g)= CO2(g)+ 2H2O(g)△H3=﹣192.2kJ/mol
回答下列问题:
(1)a = _______
(2)能说明反应CO(g)+2H2(g)![]() CH3OH(g)已达平衡状态的是___(填字母)。
CH3OH(g)已达平衡状态的是___(填字母)。
A.单位时间内生成1mol CH3OH(g)的同时消耗了1mol CO(g)
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,气体的平均摩尔质量不再变化
(3)在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与![]() 的关系如图1所示.
的关系如图1所示.
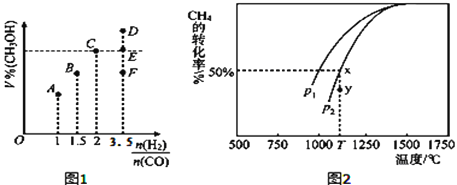
①当起始![]() =2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=_____________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将____________(选填“增大”、“减小”或“不变”);
=2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=_____________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将____________(选填“增大”、“减小”或“不变”);
②当![]() = 3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的_______点(选填“D”、“E”或“F”)。
= 3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的_______点(选填“D”、“E”或“F”)。
(4)CO和H2来自于天然气。已知CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1molL﹣1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强p1_____p2(选填“大于”或“小于”);当压强为p2时,在y点:v(正)______v(逆)(选填“大于”、“小于”或“等于”)。若p2=3MPa,则T℃时该反应的平衡常数Kp=_______MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1molL﹣1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强p1_____p2(选填“大于”或“小于”);当压强为p2时,在y点:v(正)______v(逆)(选填“大于”、“小于”或“等于”)。若p2=3MPa,则T℃时该反应的平衡常数Kp=_______MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO42-。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是( )
A. 该温度高于25℃
B. 由水电离出来的H+的浓度是1.0×10-10mol·L-1
C. NaHSO4晶体的加入抑制了水的电离
D. 该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是重要的化工原料和液体燃料,可以利用下列反应制取乙醇:2CO2(g) + 6H2(g) ![]() CH3CH2OH(g) + 3H2O(g)
CH3CH2OH(g) + 3H2O(g)
(1)写出该反应的平衡常数表达式:K=_________________________。
(2)请说明以CO2为原料合成乙醇的优点是_____________________(只要求写出一条)。
(3)在一定压强下,测得该反应的实验数据如下表:
| 500 | 600 | 700 | 800 |
1.5 | 45 | 33 | 20 | 12 |
2.0 | 60 | 43 | 28 | 15 |
3.0 | 83 | 62 | 37 | 22 |
① 该反应是___________反应(填“吸热”或“放热”)。
② 一定条件下,若提高氢碳比[n(H2)/n(CO2)],则CO2的转化率______________(填“增大”、“减小”、或“不变”)
(4)一种乙醇燃料电池中发生的化学反应为:在酸性溶液中乙醇与氧作用生成水和二氧
化碳。该电池的负极反应式为:_______________________________________。
(5)25℃、101 kPa下,H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8 kJ · mol-1、1411.0 kJ · mol-1和1366.8 kJ · mol-1,请写出由C2H4(g)和H2O(l)反应生成C2H5OH(l)的热化学方程式____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将体积均为5 mL的甲、乙、丙三种液体依次沿试管壁缓缓滴入试管中(勿振荡),出现如图所示的实验现象,则甲、乙、丙的组合可能是( )
![]()
选项 | A | B | C | D |
甲 | 1,2二溴乙烷 | 溴苯 | 水 | 乙醇 |
乙 | 水 | 液溴 | 大豆油 | 乙酸 |
丙 | 苯 | 乙醇 | 溴水 | 乙酸乙酯 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3·H2O![]() NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)
增大,应加入的物质或采取的措施是
①NH4Cl固体,②硫酸,③NaOH固体,④水,⑤加热,⑥加入少量MgSO4固体
A、①②③⑤ B、③ C、③⑥ D、③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com