
【题目】铁制品容易生锈,对钢铁制品防腐措施合理的是
A. 暂时不使用的铁锅涂上油 B. 铁质自来水管缠上铜线
C. 铜铁帽的防护栏涂上油漆 D. 自行车钢圈镀铬
科目:高中化学 来源: 题型:
【题目】2017年国产大飞机C919试飞成功,飞机上使用了碳纤维复合材料。下列物质属于复合材料的是( )
A. 玻璃钢
B. 尼龙
C. 聚氯乙烯
D. 镁铝合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来AIST报告正在研制一种“高容量、低成本”锂-铜空气燃料电池。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )

A. 放电时,Li+透过固体电解质向Cu极移动
B. 放电时,负极的电极反应式为Cu2O+H2O+2e-=2Cu+2OH-
C. 通空气时,铜被腐蚀,表面产生Cu2O
D. 整个反应过程中,铜相当于催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在工业上常用CO和H2合成甲醇,反应方程式为:
CO(g)+2H2(g)![]() CH3OH(g) △H = akJ/mol
CH3OH(g) △H = akJ/mol
已知:①CO(g)+1/2O2(g)= CO2(g) △H1=﹣283.0kJ/mol
②H2(g)+1/2O2(g)= H2O(g) △H2=﹣241.8kJ/mol
③CH3OH(g)+3/2O2(g)= CO2(g)+ 2H2O(g)△H3=﹣192.2kJ/mol
回答下列问题:
(1)a = _______
(2)能说明反应CO(g)+2H2(g)![]() CH3OH(g)已达平衡状态的是___(填字母)。
CH3OH(g)已达平衡状态的是___(填字母)。
A.单位时间内生成1mol CH3OH(g)的同时消耗了1mol CO(g)
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,气体的平均摩尔质量不再变化
(3)在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与![]() 的关系如图1所示.
的关系如图1所示.
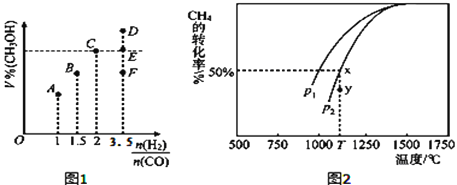
①当起始![]() =2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=_____________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将____________(选填“增大”、“减小”或“不变”);
=2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=_____________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将____________(选填“增大”、“减小”或“不变”);
②当![]() = 3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的_______点(选填“D”、“E”或“F”)。
= 3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的_______点(选填“D”、“E”或“F”)。
(4)CO和H2来自于天然气。已知CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1molL﹣1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强p1_____p2(选填“大于”或“小于”);当压强为p2时,在y点:v(正)______v(逆)(选填“大于”、“小于”或“等于”)。若p2=3MPa,则T℃时该反应的平衡常数Kp=_______MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1molL﹣1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强p1_____p2(选填“大于”或“小于”);当压强为p2时,在y点:v(正)______v(逆)(选填“大于”、“小于”或“等于”)。若p2=3MPa,则T℃时该反应的平衡常数Kp=_______MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
已知:相关物质的溶解度(20℃) Ag2SO4:0.796 g
(1)甲同学的实验如表:
序号 | 操作 | 现象 |
实验Ⅰ | 将2mL 1 molL-1 AgNO3溶液加入到1mL 1 molL-1 FeSO4溶液中 | 产生白色沉淀,随后又有黑色固体产生 |
取上层清液,滴加KSCN溶液 | 溶液变红 |
注:经检验黑色固体为Ag。
①白色沉淀的化学式是__________________。
②甲同学得出Ag+氧化了Fe2+的依据是_____________________________________。
(2)乙同学为探究Ag+和Fe2+的反应,进行实验II。
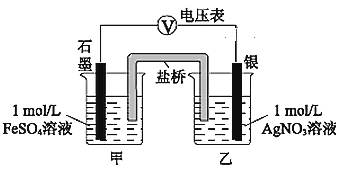
a.按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移。偏移的方向表明:电子由石墨经导线流向银。放置一段时间后,指针偏移减小。
①盐桥中盛有饱和KNO3溶液,此盐桥中钾离子向________(填“甲”或“乙”)池移动;
②若该电池能维持稳定电流强度为1 A,工作600s,理论上Ag电极的质量会________(填“增重”或“溶解”) ________g(已知F=96500 C·mol-1,电量(C)=电流(A)×时间(s) )。
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
③a中甲烧杯里的电极反应式是______________。
④b中电压表指针逆向偏移后,银为_______(填“正”或“负”)极。
(3)由上述实验得出的结论为_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是重要的化工原料和液体燃料,可以利用下列反应制取乙醇:2CO2(g) + 6H2(g) ![]() CH3CH2OH(g) + 3H2O(g)
CH3CH2OH(g) + 3H2O(g)
(1)写出该反应的平衡常数表达式:K=_________________________。
(2)请说明以CO2为原料合成乙醇的优点是_____________________(只要求写出一条)。
(3)在一定压强下,测得该反应的实验数据如下表:
| 500 | 600 | 700 | 800 |
1.5 | 45 | 33 | 20 | 12 |
2.0 | 60 | 43 | 28 | 15 |
3.0 | 83 | 62 | 37 | 22 |
① 该反应是___________反应(填“吸热”或“放热”)。
② 一定条件下,若提高氢碳比[n(H2)/n(CO2)],则CO2的转化率______________(填“增大”、“减小”、或“不变”)
(4)一种乙醇燃料电池中发生的化学反应为:在酸性溶液中乙醇与氧作用生成水和二氧
化碳。该电池的负极反应式为:_______________________________________。
(5)25℃、101 kPa下,H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8 kJ · mol-1、1411.0 kJ · mol-1和1366.8 kJ · mol-1,请写出由C2H4(g)和H2O(l)反应生成C2H5OH(l)的热化学方程式____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作①的名称是________,操作②的名称是____________。
(2)试剂a是____________(填化学式,下同),试剂b是__________,固体B是____________。
(3)加入试剂a所发生反应的化学方程式为__________________________________。
加入试剂b所发生反应的化学方程式为____________________________________。
(4)该方案能否达到实验目的:__________________________(填“能”或“不能”)。若不能,应如何改进?(若能,此问不用回答)__________。
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是____的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列比例模型,每个模型表示的分子均由C、H、O中的两种或三种构成。对各模型表示的物质的相关叙述正确的是( )
比例模型 | 对模型表示的物质的相关叙述 | |
A |
| 将形状、大小均相同的金属钠分别投入盛有0.1 mol/L的该物质的水溶液、无水乙醇和水的烧杯中,盛该物质的烧杯中产生气泡的速率最慢 |
B |
| 将灼热的铜丝反复插入盛有该物质的试管中,观察到铜丝由黑色变为光亮的红色并产生有刺激性气味的物质。此反应体现了该物质的氧化性 |
C |
| 在分液漏斗中加入该物质与碘水的混合液,充分振荡,碘水褪色,此时发生了取代反应 |
D |
| 该物质及其碳原子数小于10的同系物中,一氯代物只有一种(不考虑立体异构)的物质共有4种 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是( )
①标准状况下,11.2 L以任意比例混合的氮气和氧气所含的原子数为NA
②同温同压下,体积相同的氢气和氩气所含的分子数相等
③1 L 2 mol·L-1的AlCl3溶液中含氯离子为6NA
④标准状况下,22.4 L H2O中分子数为NA
⑤32 g O2和O3混合气体中含有原子数为2NA
A. ①②③⑤ B. ①②③④
C. ①③④ D. ③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com