


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、胶体区别于其它分散系的本质特征是具有丁达尔现象 |
| B、根据化合物中含氢数目的多少,把化合物分为一元酸、二元酸、三元酸等 |
| C、碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 |
| D、强电解质溶液的导电能力一定强于弱电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
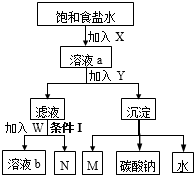
| A、X和M是同种物质 |
| B、W是氯化钠固体和X |
| C、溶液b和N能循环利用 |
| D、条件Ⅰ是加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 检测次数 | 溶液中检测出的溶质 |
| 第一次 | KCl、K2SO4、Na2CO3、NaCl |
| 第二次 | KCl、BaCl2、Na2CO3、K2CO3 |
| 第三次 | Na2CO3、KCl、K2SO4、NaCl |
2- 4 |
2- 3 |
| 实验步骤 | 实验操作 | 实验目的 | 反应的离子方程式 | ||
| 第一步 | 向溶液中滴加过量的HNO3溶液 | 检验 | |||
| 第二步 | 继续滴加过量的 | 检验SO
| |||
| 第三步 | 过滤、再向滤液中滴加 | 检验 | Ag++Cl-=AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应物 | a+b | c+d | a+d | a+c | b+d |
| 现象 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(H+)=1×10-2mol?L-1的溶液:Na+、NH4+、CO32-、SO42- |
| B、水电离产生的c(H+)=1×10-12mol/L溶液:Fe2+、Ca2+、I-、NO3- |
| C、含有大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- |
| D、能使pH试纸变深蓝色的溶液中:Na+、AlO2-、S2-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com