
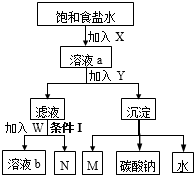
| A、X和M是同种物质 |
| B、W是氯化钠固体和X |
| C、溶液b和N能循环利用 |
| D、条件Ⅰ是加热 |


科目:高中化学 来源: 题型:
| A、若溶液中加入NaOH溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,说明原溶液中含有NH4+ |
| B、若溶液中加入BaCl2溶液有白色沉淀生成,再加稀盐酸沉淀不溶解,说明原溶液中含有SO42- |
| C、若溶液中加入CaCl2溶液有白色沉淀生成,再加稀盐酸沉淀溶解并产生无色无味的气体,说明原溶液中含有CO32- |
| D、若溶液中加稀硝酸酸化后再加入AgNO3溶液有白色沉淀生成,说明原溶液中含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
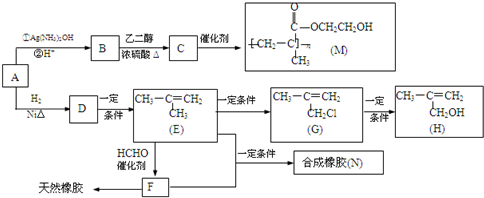
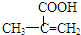 ,该不饱和酸有多种同分异构体,请写出属于酯类且含有碳碳双键的同分异构体的结构简式
,该不饱和酸有多种同分异构体,请写出属于酯类且含有碳碳双键的同分异构体的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作① |
| 加试剂A |
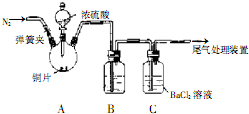
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com