
【题目】向20mL某物质的量浓度的AlCl3溶液中滴加2mol/LNaOH溶液时,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH溶液的体积(mL)和所得沉淀的物质的量(mol)的关系如图所示。则:
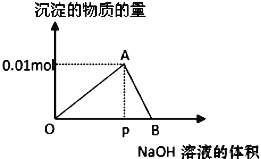
(1)写出OA段发生反应的离子方程式:OA段___,图中线段OP:PB=__,
(2)计算原AlCl3溶液的物质的量浓度为__mol/L,
(3)图中A对应的横坐标为__mL,
(4)当加入5mLNaOH溶液时,产生沉淀量为__mol,
(5)当加入的NaOH溶液过量时,使最初生成的沉淀部分溶解,要得到与(4)中相同的沉淀量,加入NaOH溶液的体积为__mL。
【答案】Al3++3OH﹣=Al(OH)3↓ 3:1 0.5 15 0.0033(或![]() ) 18.33(或
) 18.33(或![]() )
)
【解析】
向20mL某物质的量浓度的AlCl3溶液中滴加2mol/L NaOH溶液时,逐滴加入NaOH溶液直至过量,过程中发生的反应为①Al3++3OH-=Al(OH)3↓,②Al(OH)3+OH-=AlO2-+2H2O,图象中OA段为发生反应①,AB段为氢氧化铝溶解发生反应②,依据各步反应分析判断,进行有关计算。
(1)依据分析可知OA段发生的反应是氯化铝和氢氧化钠反应生成氢氧化铝沉淀至最大量的过程,反应离子方程式为:Al3++3OH-=Al(OH)3↓; AB段发生的是氢氧化铝溶解在氢氧化钠溶液中至沉淀全部溶解,根据反应①Al3++3OH-=Al(OH)3↓,②Al(OH)3+OH-=AlO2-+2H2O得到生成最大量沉淀和沉淀全部溶解所消耗氢氧化钠物质的量之比为3:1,氢氧化钠溶液浓度一定,所以消耗的NaOH溶液体积比为3:1,
故答案为:Al3++3OH-=Al(OH)3↓;3:1;
(2)图象中分析得到最大量氢氧化铝沉淀物质的量为0.01mol,根据Al守恒,所以氯化铝物质的量为0.01mol,氯化铝溶液浓度=![]() =0.5mol/L,
=0.5mol/L,
故答案为:0.5;
(3)图象中分析得到最大量氢氧化铝沉淀物质的量为0.01mol,所以消耗氢氧化钠物质的量为0.03mol,氢氧化钠溶液的体积=![]() =
=![]() =0.015L=15mL,
=0.015L=15mL,
故答案为:15;
(4)当加入5mLNaOH溶液时,产生沉淀量依据反应Al3++3OH-=Al(OH)3↓;计算得到:
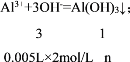
n=0.0033mol(或![]() mol),
mol),
故答案为:0.0033(或![]() );
);
(5)当加入的NaOH溶液过量时,使最初生成的沉淀部分溶解,要得到与(4)中相同的沉淀量,则发生反应Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O,最大量沉淀为0.01mol,消耗氢氧化钠物质的量为0.03mol,溶解的沉淀物质的量=0.01mol0.0033mol=0.0067mol,溶解0.0067mol氢氧化铝消耗氢氧化钠为0.0067mol;所以共消耗氢氧化钠物质的量=0.0067mol+0.03mol=0.0367mol;需要氢氧化钠溶液体积=![]() =0.01833L=18.35mL[或
=0.01833L=18.35mL[或![]() mL(依据沉淀量为
mL(依据沉淀量为![]() mol计算)];
mol计算)];
故答案为:18.35(或![]() )。
)。


科目:高中化学 来源: 题型:
【题目】化合物X的分子式为C5H11Cl,用NaOH的醇溶液处理X,可得分子式为C5H10的两种产物Y、Z,Y、Z经催化加氢后都可得到2甲基丁烷。若将化合物X用NaOH的水溶液处理,则所得有机产物的结构简式可能是( )
A.CH3CH2CH2CH2CH2OH B.(CH3)2COHCH2CH3
C.(CH3)2CHCH2CH2OH D.(CH3)3CCH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下各物质的溶度积或电离平衡常数如下:
Ksp(CuS)=1.3×10-36,Ksp(FeS)=6.5×10-18
H2S:Ka1=1.2×10-7,Ka2=7×10-15
一般来说,如果一个反应的平衡常数大于105,通常认为反应进行得较完全;如果一个反应的平衡常数小于10-5,则认为该反应很难进行。请回答:
(1)向浓度均为0.1 mol·L-1的FeSO4和CuSO4的混合溶液中加Na2S溶液,请写出首先出现沉淀的离子方程式________________。
当加入Na2S溶液至出现两种沉淀,则溶液中c(Fe2+)∶c(Cu2+)=________。
(2)通过计算说明反应CuS(s)+2H+=Cu2++H2S进行的程度________________。
(3)常温下,NaHS溶液呈碱性,此时溶液中离子浓度由大到小的顺序是_________。
若向此溶液中加入CuSO4溶液,恰好完全反应,所得溶液的pH________(填“>”“<”或“=”)7。用离子方程式表示其原因____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量之比为

A.6:1B.3:1C.2:1D.1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室通过称量![]() 样品受热脱水前后的质量来测定x值,下列情况会导致测定值偏低的是( )
样品受热脱水前后的质量来测定x值,下列情况会导致测定值偏低的是( )
A. 实验前试样未经干燥B. 试样中含有少量碳酸氢铵
C. 试样中含有少量氯化钠D. 加热过程中有试样迸溅出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以葡萄糖为原料制得的山梨醇(A)和异山梨醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物,由葡萄糖为原料合成E的过程如下:
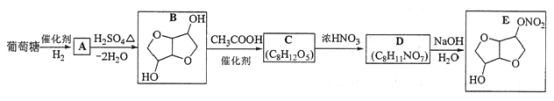
回答下列问题:
(1)葡萄糖的分子式为__________。
(2)A中含有的官能团的名称为__________。
(3)由B到C的反应类型为__________。
(4)C的结构简式为__________。
(5)由D到E的反应方程式为______________。
(6)F是B的同分异构体,7.30 g的F与足量饱和碳酸氢钠反应可释放出2.24 L二氧化碳(标准状况),F的可能结构共有________种(不考虑立体异构),其中核磁共振氢谱为三组峰,峰面积比为3∶1∶1的结构简式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500 mL NH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入足量NaOH溶液,充分反应后消耗 a mol NaOH ,另取一份加入足量盐酸,充分反应后消耗b mol HCl,则该混合溶液中c(Na+)为 ( )(已知:NH4++ OH—= NH3·H2O)
A.(![]() )mol/LB.(5a—
)mol/LB.(5a—![]() )mol/L
)mol/L
C.(10b-5a) mol/LD.(2b-a) mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某元素原子M层电子数是K层电子数的一半,该元素的原子结构示意图是______________。
(2)碘的质子数为53,碘有多种核素,其中中子数为74的核素的原子符号是________。
(3)某阳离子ARn+,核外共有x个电子,则该原子核内的中子数为 __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KA1(SO4)2·12H2O]是一种复盐,在造纸等方面应用广泛。采用废易拉罐制备明矾的过程如下图所示。
下列叙述错误的是
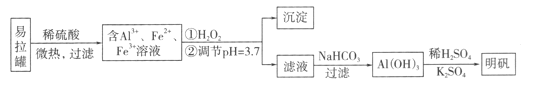
A. 合理处理易拉罐有利于环境保护和资源再利用
B. 从易拉罐中可回收的金属元素有Al、Fe
C. “沉淀”反应的金属离子为Fe3+
D. 上述流程中可用NaHSO4代替NaHCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com