
| A. | 凡是能量达到活化能的分子发生的碰撞均为有效碰撞 | |
| B. | 熵增大的反应都是自发反应,熵减少的反应都不能进行 | |
| C. | 升高温度,可逆反应的正反应速率和逆反应速率都一定增大 | |
| D. | 使用催化剂可以增加反应物分子的能量,从而增大反应速率 |
分析 A.活化分子碰撞需要合适的方向才发生反应;
B.△H-T△S<0的反应可自发进行;
C.升高温度,提供分子转化为活化分子需要的能量;
D.使用催化剂,降低反应需要的活化能.
解答 解:A.活化分子碰撞需要合适的方向才发生反应,则能量达到活化能的分子发生的碰撞不一定为有效碰撞,故A错误;
B.△H-T△S<0的反应可自发进行,则熵增大、熵减少的反应都可能自发反应,故B错误;
C.升高温度,提供分子转化为活化分子需要的能量,则可逆反应的正反应速率和逆反应速率都一定增大,故C正确;
D.使用催化剂,降低反应需要的活化能,反应速率加快,不能增加反应物分子的能量,故D错误;
故选C.
点评 本题考查反应速率的影响因素,为高频考点,把握活化理论、温度和催化剂对反应速率的影响为解答的关键,侧重分析与应用能力的考查,题目难度不大,选项A为易错点.


科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始浓度/(mol•L-1) | 0.1 | 0.2 | 0 |
| 2min末浓度/(mol•L-1) | 0.08 | a | b |
| 平衡浓度/(mol•L-1) | 0.05 | 0.05 | 0.1 |
| A. | 平衡时,X的转化率为5% | |
| B. | t℃时,该反应的平衡常数为40 | |
| C. | 增大平衡后的体系压强,v(正)增大,v(逆)减小,平衡向正反应方向移动 | |
| D. | 2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性溶液中:Cl-、SO42-、Fe3+、Mg2+ | |
| B. | 使酚酞变红的溶液中:Na+、CO32-、Cl-、Al3+ | |
| C. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| D. | 1.0 mol•L-1的CuSO4溶液:H+、Ba2+、AlO2-、NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
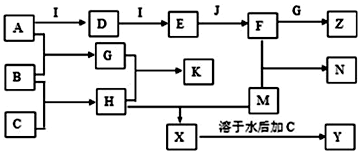
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
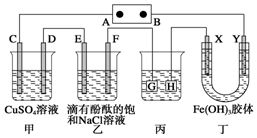 如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中 KMnO4被氧化 | |
| B. | 氧化产物与还原产物的物质的量之比为 2:5 | |
| C. | 每生成 1 mol Cl2时,反应中转移的电子为 2 mol | |
| D. | 每消耗 16 molHCl 时,其中作氧化剂的 HCl 是 10 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | 0.02mol/L的NaOH溶液与0.04mol/L的NaHC2O4溶液等体积混合液:2c(OH-)+c(C2O42-)=c(HC2O4)+2c(H+) | |
| C. | 叠氨酸(NH3)与醋酸酸性相近,0.1mol•L-1 NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3-)>c(OH-)>c(H+) | |
| D. | 向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+)=c(Cl-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com