
 cW(g),达到平衡后,测得M气体的浓度为0.5mol/L。恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L。则下列叙述正确的是( )
cW(g),达到平衡后,测得M气体的浓度为0.5mol/L。恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L。则下列叙述正确的是( )| A.反应速率增大 | B.平衡向正反应方向移动 |
| C.N的转化率提高 | D.W的体积分数降低 |
科目:高中化学 来源:不详 题型:单选题
 pC(g)+qD(g) △H<0。下列结论中错误的是( )
pC(g)+qD(g) △H<0。下列结论中错误的是( )查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g) + 2D(g)达平衡时C的含量为m%,保持温度不变,若按下列配比的物质放入该容器中,达平衡时C的含量仍为m%的是( )
C(g) + 2D(g)达平衡时C的含量为m%,保持温度不变,若按下列配比的物质放入该容器中,达平衡时C的含量仍为m%的是( )| A.2molA和1molB | B.2molD,1molA和1molB |
| C.2molC和4molD | D.1molC和1molD |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 NH3·H2O
NH3·H2O NH4++OH-;②气体的溶解度随温度的升高而降低。实验室中也常用氨水滴入生石灰中制取氨气,请用平衡的有关理论来解释之。
NH4++OH-;②气体的溶解度随温度的升高而降低。实验室中也常用氨水滴入生石灰中制取氨气,请用平衡的有关理论来解释之。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO(g)+H2O(g) △H=Q,化学平衡常数K与温度T的关系如下表:
CO(g)+H2O(g) △H=Q,化学平衡常数K与温度T的关系如下表:| T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Z(g)+2W(g) ΔH<0,达到平衡(Ⅰ)时,V(B)=0.8a L。
Z(g)+2W(g) ΔH<0,达到平衡(Ⅰ)时,V(B)=0.8a L。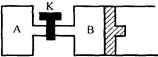
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CO(g)+H2(g) ;ΔH >0,下列有关说法正确的是
CO(g)+H2(g) ;ΔH >0,下列有关说法正确的是 A.平衡常数表达式为K=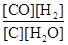 |
| B.增大体系压强,平衡常数K不发生变化 |
| C.升高体系温度,平衡常数K减小 |
| D.增加C(s)的量,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.新制的氯水在光照下颜色变浅 |
| B.H2、I2、HI平衡混合气加压后颜色变深 |
| C.合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施 |
| D.实验室用排饱和食盐水而不用排水法收集氯气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3的平衡常数K=a,则此温度下,NH3
2NH3的平衡常数K=a,则此温度下,NH3
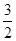 H2+
H2+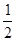 N2的平衡常数为( )
N2的平衡常数为( )| A.a-1/2 | B.a1/2 | C.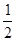 a a | D.a-2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com