
【题目】已知砒霜As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4===2AsH3+6ZnSO4+3H2O
(1)请用“双线桥法”标出电子转移的方向和数目:______________________。
(2)As2O3在上述反应中________。
A.被氧化 B.被还原
C.既被氧化又被还原 D.既未被氧化又未被还原
(3)该反应的氧化产物是________,氧化剂是________。
(4)若生成0.1 mol AsH3,则转移的电子数为________。(用NA表示)
【答案】 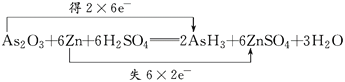 B ZnSO4 As2O3 0.6NA
B ZnSO4 As2O3 0.6NA
【解析】(1)反应中,每个Zn原子失去2个电子,2个As原子得到12个电子,根据电子守恒,转移电子是12,则双线桥法标出电子转移的方向和数目为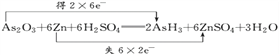
(2)As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O中,As元素的化合价降低,则As2O3为氧化剂,表现氧化性,被还原,故选B。(3)As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O中中,As元素的化合价降低,则As2O3为氧化剂,被还原,Zn是还原剂,被氧化,氧化产物为ZnSO4;(4)As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O中生成2molAsH3转移12mol电子,则生成0.1molAsH3,则转移的电子数为0.6mol电子,即转移的电子数为0.6NA。


科目:高中化学 来源: 题型:
【题目】下列叙述中错误的是
A.电解池是电能转化为化学能的装置
B.原电池跟电解池连接后,电子从原电池负极流向电解池阴极,经过电解质溶液到达电解池的阳极,然后再回流到原电池的正极,形成闭合回路
C.电解时,阳极发生氧化反应
D.电解时,阳离子移向阴极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是一种重要的化工原料,既可用于制药,又可用作火箭燃料。回答下列问题:
(1)已知反应的热化学方程式如下:
①N2H4(g)![]() N2(g)+2H2(g) △H1;
N2(g)+2H2(g) △H1;
②N2(g)+3H2(g)![]() 2NH3(g) △H2。
2NH3(g) △H2。
反应热△H1 _____(填“大于”或“小于”) △H2。向2 L的恒容密闭容器中充入1 mol N2H4,发生反应①,![]() (用x表示)与时间的关系如图1所示,则该温度下,反应①的平衡常数K=___________________。
(用x表示)与时间的关系如图1所示,则该温度下,反应①的平衡常数K=___________________。

(2)肼在另一条件下也可达到分解平衡,同时生成两种气体,且其中一种气体能使湿润的红色石蕊试纸变蓝。图2为平衡体系中肼的体积分数与温度、压强的关系。
①该反应的化学方程式为________________________________________。
②p2_______ (填“大于”或“小于”) p1。
③图中N2H4的平衡体积分数随温度升高而降低,其原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)原电池反应通常是放热反应,下列反应中在理论上可设计成原电池的反应为________(填字母), 理由是_______________________________________。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(aq)+2NH3·H2O(aq)+8H2O(l) △H>0
C.CaC2(s)+2H2O(l)=Ca(OH)2(s)+C2H2(g) △H <0
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H <0
(2)以KOH溶液为电解质溶液,依据(1)所选反应设计原电池,其负极反应为________________。
(3)电解原理在化学工业中有着广泛的应用,现将设计的原电池通过导线与图中电解池相连,其中a为电解液,X和Y为两块电极板,则:

①若X和Y均为惰性电极,a为饱和NaCl溶液,则电解时检验Y电极反应产物的方法是___________。
②若X和Y分别为石墨和铁,a仍为饱和NaCl溶液,则电解过程中生成的白色固体物质露置在空气中,可观察到的现象是________________________________。
③若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1 molCuO,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO和KClO3,且![]() 的值与温度高低有关.当n(KOH)=amol时,下列有关说法错误的是( )
的值与温度高低有关.当n(KOH)=amol时,下列有关说法错误的是( )
A. 若某温度下,反应后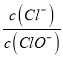 =2,则溶液中
=2,则溶液中 =0.2
=0.2
B. 参加反应的氯气的物质的量等于0.5a mol
C. 改变温度,反应中转移电子的物质的量ne的范围: ![]() a mol≤ ne ≤
a mol≤ ne ≤![]() a mol
a mol
D. 改变温度,产物中KClO3的最大理论产量为![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+B(g)![]() 2C(g)+2D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是
2C(g)+2D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是
A. V(A)=0.4mol/(L·min) B. V(B)=0.5mol/(L·min)
C. V(C)=0.5mol/(L·min) D. V(D)=0.02mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,断裂1molN≡N吸收942kJ热量.根据以上信息和数据,下列说法正确的是( )

A. N4属于一种新型的化合物,与N2互为同素异形体
B. N4的沸点比白磷(P4)的高
C. 1mol N4转化为2mol N2的同时放出能量
D. 相同质量的N4和 N2所含原子个数比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸工业尾气中含有高浓度的NO和NO2,它们都是大气的重要污染物。已知某厂排放的尾气中NO、NO2的体积比为1:1,该厂采用NaOH溶液来处理该尾气,处理后所得溶液中只有一种含氮的钠盐。则该含氮的钠盐中,氮元素的化合价为 ( )
A.-3B.+1C.+3D.+5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁是常见的水处理剂,无水FeCl3 的熔点为282℃,沸点为315℃。工业上制备无水FeCl3 的一种工艺流程如下:

(1)氯化铁的净水原理和最常用的____________________(写出结晶水合物的化学式)净水原理相同。
(2)捕集器中温度超过400℃时,捕集到另一种物质,其相对分子质量为325,该物质的分子式为________。
(3)吸收塔中反应的离子方程式是__________________。
(4)从副产物FeCl3 溶液中获得FeCl3·6H2O 的方法是在溶液中加入适量的浓盐酸,再进行___________、__________、过滤,洗涤、晾干。
(5)FeCl3的质量分数通常可用碘量法测定:称取m克无水氯化铁样品(不考虑杂质是否反应),溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10mL,加入稍过量的KI溶液,充分反应后,滴入2-3滴淀粉溶液,当滴定终点时,用去cmol/LNa2S2O3溶液滴定用去VmL.
(已知:第一步反应2Fe3++2I—= I2+2Fe2+;第二步反应 I2+2S2O32-=2I-+S4O62-)
该实验确定样品中氯化铁的质量分数为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com