
【题目】已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO和KClO3,且![]() 的值与温度高低有关.当n(KOH)=amol时,下列有关说法错误的是( )
的值与温度高低有关.当n(KOH)=amol时,下列有关说法错误的是( )
A. 若某温度下,反应后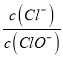 =2,则溶液中
=2,则溶液中 =0.2
=0.2
B. 参加反应的氯气的物质的量等于0.5a mol
C. 改变温度,反应中转移电子的物质的量ne的范围: ![]() a mol≤ ne ≤
a mol≤ ne ≤![]() a mol
a mol
D. 改变温度,产物中KClO3的最大理论产量为![]() mol
mol
【答案】A
【解析】A.令n(ClO-)=1mol,反应后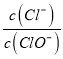 =2,则n(Cl-)=2mol,根据电子转移守恒,5×n(ClO3-)+1×n(ClO-)=1×n(Cl-),即5×n(ClO3-)+1×1mol=1×2mol,解得n(ClO3-)=0.2mol,则溶液中
=2,则n(Cl-)=2mol,根据电子转移守恒,5×n(ClO3-)+1×n(ClO-)=1×n(Cl-),即5×n(ClO3-)+1×1mol=1×2mol,解得n(ClO3-)=0.2mol,则溶液中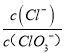 =
=![]() =10,故A错误;B.由Cl原子守恒可知,2n(Cl2)=n(KCl)+n(KClO)+n(KClO3),由钾离子守恒可知n(KCl)+n(KClO)+n(KClO3)=n(KOH),故参加反应的氯气的物质的量=
=10,故A错误;B.由Cl原子守恒可知,2n(Cl2)=n(KCl)+n(KClO)+n(KClO3),由钾离子守恒可知n(KCl)+n(KClO)+n(KClO3)=n(KOH),故参加反应的氯气的物质的量=![]() n(KOH)=0.5amol,故B正确;C.氧化产物只有KClO3时,转移电子最多,根据电子转移守恒n(KCl)=5(KClO3),由钾离子守恒:n(KCl)+n(KClO3)=n(KOH),故n(KClO3)=
n(KOH)=0.5amol,故B正确;C.氧化产物只有KClO3时,转移电子最多,根据电子转移守恒n(KCl)=5(KClO3),由钾离子守恒:n(KCl)+n(KClO3)=n(KOH),故n(KClO3)= ![]() n(KOH)=
n(KOH)= ![]() a mol,转移电子最大物质的量为:
a mol,转移电子最大物质的量为: ![]() a mol×5=
a mol×5=![]() a mol,氧化产物只有KClO时,转移电子最少,根据电子转移守恒n(KCl)=n(KClO),根据钾离子守恒:n(KCl)+n(KClO)=n(KOH),故:n(KClO)=
a mol,氧化产物只有KClO时,转移电子最少,根据电子转移守恒n(KCl)=n(KClO),根据钾离子守恒:n(KCl)+n(KClO)=n(KOH),故:n(KClO)= ![]() n(KOH)=
n(KOH)= ![]() a mol,转移电子最小物质的量=
a mol,转移电子最小物质的量=![]() a mol×1=
a mol×1=![]() a mol,则反应中转移电子的物质的量ne的范围为:
a mol,则反应中转移电子的物质的量ne的范围为: ![]() a mol≤ne≤
a mol≤ne≤![]() a mol,故C正确;D.氧化产物只有KClO3时,其物质的量最大,根据电子转移守恒n(KCl)=5(KClO3),由钾离子守恒:n(KCl)+n(KClO3)=n(KOH),故n最大(KClO3)=
a mol,故C正确;D.氧化产物只有KClO3时,其物质的量最大,根据电子转移守恒n(KCl)=5(KClO3),由钾离子守恒:n(KCl)+n(KClO3)=n(KOH),故n最大(KClO3)= ![]() n(KOH)=
n(KOH)= ![]() a mol,故D正确;故选A。
a mol,故D正确;故选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】汽车尾气中NO产生的反应为N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是

A. 曲线b对应的条件改变可能是加入了催化剂
B. 温度T下,随着反应的进行,混合气体的密度减小
C. 温度T下,该反应的平衡常数K=![]()
D. 若曲线b对应的条件改变是温度,可判断该反应的ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸在不同的反应中,可以分别表现出酸性、氧化性和还原性。现在有如下三个反应,有关判断正确的是( )
①Zn+2HCl![]() ZnCl2+H2↑;②NaOH+HCl
ZnCl2+H2↑;②NaOH+HCl![]() NaCl+H2O;
NaCl+H2O;
③2HCl![]() H2↑+Cl2↑
H2↑+Cl2↑
选项 | 有关判断 |
A | 反应①是置换反应,HCl表现还原性 |
B | 反应②是复分解反应,HCl表现氧化性 |
C | 反应③中HCl既表现氧化性也表现还原性 |
D | 反应①中氢原子失去电子 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应既属于氧化还原反应有属于吸热反应的是( )
A. Na与水反应 B. 灼热的碳与CO2反应
C. 铝片与稀盐酸反应 D. 氢氧化钡晶体与氯化铵反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉。这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称"引火铁"。请分别用下图中示意的两套仪器装置,制取上述铁的氧化物和"引火铁",实验中必须使用普通铁粉和6摩/升盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。

按要求填写下列空白:
(1)实验进行时试管A中应加入的试剂是__________;烧瓶B的作用是___ ;烧瓶C的作用是___________________;在试管D中收集得到的是____________。
(2)实验时,U型管G中应加入的试剂是____________;长颈漏斗H中应加入____。
(3)两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母)____________。
(4)试管E中发生反应的化学方程式是______________________________。
(5)为了安全,在E管中的反应发生前,在F出口处必须_____;E管中的反应开始后,在F出口处应____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知砒霜As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4===2AsH3+6ZnSO4+3H2O
(1)请用“双线桥法”标出电子转移的方向和数目:______________________。
(2)As2O3在上述反应中________。
A.被氧化 B.被还原
C.既被氧化又被还原 D.既未被氧化又未被还原
(3)该反应的氧化产物是________,氧化剂是________。
(4)若生成0.1 mol AsH3,则转移的电子数为________。(用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是( )

A. 上图所示实验可证明元素的非金属性:Cl>C>Si
B. 第三周期主族元素的最高正价随原子序数递增而依次增大
C. 气态氢化物的稳定性:H2O>NH3>CH4
D. 第115号元素在周期表中位于第七周期第VA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是
A. SO2具有氧化性,常用于漂白秸秆、织物
B. 明矾水解形成Al(OH)3胶体,可用作水处理中的净水剂
C. 石英坩埚耐高温,可用来加热熔化烧碱、纯碱等固体
D. 次氯酸有酸性,可用于自来水的杀菌消毒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com