
下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(-57.3) kJ/mol
B.CO(g)的燃烧热是283.0 kJ/mol,则表示CO燃烧热的热化学方程式为CO(g)+1/2O2(g)===CO2 (g);△H=-283.0 kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1 mol硫燃烧生成气态三氧化硫所放出的热量是硫磺的燃烧热
B
【解析】
试题分析:A、中和热是指在稀溶液中,强酸与强碱的稀溶液完全反应生成1 mol H2O所放出的热量,所以H2SO4和Ca(OH)2反应的中和热也为ΔH=-57.3 kJ?mol-1,错误;B、根据燃烧热的概念判断;CO(g)的燃烧热是283.0 kJ/mol,则表示CO燃烧热的热化学方程式为CO(g)+1/2O2(g)===CO2 (g);△H=-283.0 kJ/mol,正确;C、需要加热才能发生的反应不一定是吸热反应,如铝热反应、碳的燃烧等,错误;D、燃烧热是指1 mol可燃物完全燃烧生成稳定的化合物所放出的热量,硫燃烧应生成气态二氧化硫,错误。
考点:考查化学反应中的能量变化,燃烧热、中和热的概念。


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源:2013-2014福建省福州八县第二学期期中考试高一化学试卷(解析版) 题型:选择题
化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是( )
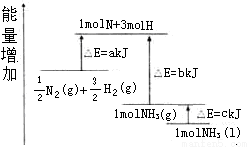
A.N2(g)+3H2(g)=2NH3(1);△H=2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g)=2NH3(g);△H=2(b-a)kJ·mol-1
C. N2(g)+
N2(g)+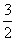 H2(g)=NH3(1);△H=(h+c-a)kJ·mol-1
H2(g)=NH3(1);△H=(h+c-a)kJ·mol-1
D. N2(g)+
N2(g)+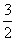 H2(g)=NH3(g);△H=(a+b)kJ·mol-1
H2(g)=NH3(g);△H=(a+b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省漳州市八校高三第四次联考理综化学试卷(解析版) 题型:选择题
甲、乙、丙、丁均为中学化学常见的物质,它们之间的转化关系如下图(反应条件及其它产物已略去)。
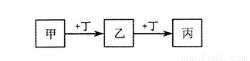
下列说法不正确的是
A.若甲是AlCl3溶液,则丁可能是NaOH溶液
B.若甲是Fe,则丁可能是Cl2
C.若丁是CO2,则甲可能为Mg
D.若丁是O2,则乙、丙的相对分子质量可能相差16
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.液态HCl、固态NaCl均不导电,所以HCl、NaCl是非电解质
B.NH3、CO2、Cl2的水溶液均能导电,所以NH3、CO2、Cl2均是电解质
C.蔗糖、酒精在液态或水溶液里均不导电,所以它们是非电解质
D.铜、石墨均导电,所以它们是电解质
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列有关金属的腐蚀与防护的说法中,不正确的是
A.温度越高,金属腐蚀速率越快
B.在铁管外壁上镀锌可防止其被腐蚀
C.金属被腐蚀的本质是金属发生了氧化反应
D.将钢闸门与直流电源的正极相连可防止其被腐蚀
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省宁德市高三5月质检理综化学试卷(解析版) 题型:简答题
(15分)氯化亚铜(CuCl)是一种白色固体,微溶于水,不溶于酒精。研究该物质的应用新领域、生产新方法及生产过程中的环保新措施都具有重要意义。
(1)镁—氯化亚铜海水电池,可用于鱼雷上。该电池被海水激活时,正极导电能力增强,同时产生气泡,则正极上被还原的物质有 、 (填化学式)。
(2)工业上以铜作催化剂,氯代甲烷和硅粉反应合成甲基氯硅烷的过程中产生大量废渣(主要成分为硅粉、铜、碳等)。某课外小组以该废渣为原料制CuCl,流程示意图如下:
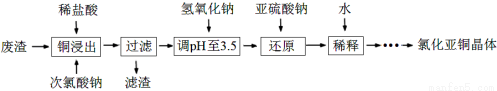
回答下列问题:
①氯代甲烷有4种,其中属于重要工业溶剂的是 (写出化学式)。
②“还原”阶段,SO32-将Cu2+还原得[CuCl2]-,完成下列离子方程式。
 Cu2++
Cu2++ Cl-+
Cl-+ SO32-+
SO32-+ =
= [CuCl2]-+
[CuCl2]-+ +
+
③在稀释过程中存在下列两个平衡:
ⅰ [CuCl2]- CuCl+Cl- K=2.32
CuCl+Cl- K=2.32
ⅱ CuCl(s) Cu+(aq)+Cl- Ksp=1.2×10-6
Cu+(aq)+Cl- Ksp=1.2×10-6
当[CuCl2]-完成转化时(c([CuCl2]-)≤1.0×10-5 mol·L-1),溶液中c(Cu+)≥ 。
④获得CuCl晶体需经过滤、洗涤、干燥。洗涤时,常用无水乙醇代替蒸馏水做洗涤剂的优点是 (写一点)。
(3)工业生产CuCl过程中产生浓度为2~3 g·L-1的含铜废水,对人及环境都有较大的危害,必须进行回收利用。用萃取法富集废水中的铜,过程如下:

①实验室完成步骤ⅰ时,依次在分液漏斗中加入曝气后的废水和有机萃取剂,经振荡并 后,置于铁架台的铁圈上静置片刻,分层。分离上下层液体时,应先 ,然后打开活塞放出下层液体,上层液体从上口倒出。
②写出步骤ⅱ的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省宁德市高三5月质检理综化学试卷(解析版) 题型:选择题
下列有关实验的说法不正确的是
A.取用液溴时,应戴上橡皮手套
B.配制一定物质的量浓度的NaCl溶液时,NaCl应在烧杯中溶解
C.加热乙酸、乙醇、浓硫酸的混合物制备乙酸乙酯时,应加入2~3块碎瓷片
D.无色溶液中滴加硝酸酸化的BaCl2溶液,产生白色沉淀,则溶液中一定含有SO42-
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高三热身考试化学试卷(解析版) 题型:填空题
黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为:
2KNO3+3C+S K2S+N2↑+3CO2↑
K2S+N2↑+3CO2↑
(1)上述反应中,原子半径最小的元素其原子结构示意图为________________。
(2)上述反应生成物中,属于非电解质的是________。
(3)上述反应中,每生成1 mol氧化产物,消耗KNO3的质量为 (保留1位小数)。
(4)收集黑火药爆炸后的烟尘和气体产物,分别与酸性高锰酸钾溶液反应,均能使溶液紫红色退去。
①烟尘中能使酸性高锰酸钾溶液退色的物质是 (填化学式)。
②气体产物与酸性高锰酸钾溶液反应的离子方程式 。
③利用下图装置检验气体产物中的CO气体,一段时间后,观察到B中出现黑色的Pd沉淀,写出B中发生反应的化学方程式 。
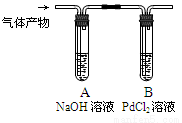
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列物质的水溶液在适当加热时酸性增强的是
A.氯化铁 B.氯化钠 C.盐酸 D.碳酸钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com