
| A、标况下,11.2 L氯气完全溶于1 L水中,所得溶液中Cl-和ClO-两种粒子数之和为NA |
| B、密闭容器中,0.1 mol H2和25.4 g碘在一定条件下充分反应,生成HI分子数为0.2 NA |
| C、含有4 NA个碳碳σ键的金刚石,其质量为24 g |
| D、含0.1 mol FeCl3的溶液完全水解后得到的胶体粒子个数为0.1 NA |
| 1 |
| 2 |
| 4mol |
| 2 |


科目:高中化学 来源: 题型:
| ||
| 原电池 | 电解池 | |
| A | H+移向Pb电极 | H+移向Pb电极 |
| B | 每消耗3molPb | 生成2molAl2O3 |
| C | 正极:PbO2+4H++2e-═Pb2++2H2O | 阳极:2Al+3H2O-6e-═Al2O3+6H+ |
| D | 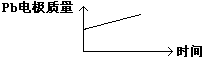 | 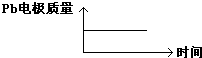 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、作质谱分析,质谱图中质荷比的最大值为46 |
| B、作红外光谱分析,谱图上有C-H、C-O和O-H键的吸收峰 |
| C、作核磁共振氢谱分析,在谱图中出现3个吸收峰,其强度比为3:2:1 |
| D、向CH3-CH2-OH中加入金属钠,有H2放出,证明该有机物显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、少量SO2通入NaOH 溶液中:OH-+SO2→HSO3- |
| B、H2S 通入氯水中:S2-+Cl2→S↓+2Cl- |
| C、二氧化氮溶于水:3NO2+H2O=2H++2NO3-+NO↑ |
| D、H2SO4 与Ba(OH)2 溶液反应:H++SO42-+Ba2++OH-→BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同质量、不同密度的N2和CO |
| B、同温度、同体积的H2和N2 |
| C、同体积、同密度的C2H6和NO |
| D、同压强、同电子数的N2O和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu与AgNO3溶液反应:Cu+Ag+═Cu2++Ag |
| B、Fe与盐酸的反应放出H2:Fe+2H+═Fe2++H2↑ |
| C、大理石与盐酸反应放出CO2气体:CO32-+2H+═CO2↑+H2O |
| D、氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu+HNO3(浓)→Cu(NO3)2 | ||||
| B、Cu+HNO3(稀)→Cu(NO3)2 | ||||
C、Cu
| ||||
| D、Cu+AgNO3→Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/min | 2 | 4 | 7 | 9 |
| n(H2)/mol | 0.11 | 0.09 | 0.07 | 0.07 |
| A、反应前2min的平均速率υ(H2)=0.0075mol/(L?min) |
| B、其他条件不变,升高温度,反应达到新平衡前υ(正)>υ(逆) |
| C、其他条件不变,充入0.2molH2,再次达到平衡时,CH3OH的体积分数增大 |
| D、第2~4min、第4~7min,H2的平均速率:υ(2~4)=υ(4~7) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com