
【题目】下表是元素周期表中的一部分,回答下列问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ | ⑾ | ⑿ |
(1)写出下列元素名称①_______,⑤_______,⑨_______,⑾________。
(2)在这些元素中,金属性最强的元素是_______;除稀有气体元素以外的元素中原子半径最大的是_______,原子半径最小的是______。其氢化物最稳定的是____。(填写元素符号)
(3)元素②和③形成的离子的电子层结构_________(填“相同”或“不相同”),两者形成的化合物是否是离子化合物________(填“是”或否”),该化合物的电子式为______________。
(4)元素⑧的最高价氧化物对应的水化物化学式为:______名称为______:。
(5)在这些元素的最高价氧化物对应的水化物中,属于两性氢氧化物的是_________(填写化学式),写出其和盐酸反应的化学方程式__________________________________________。
【答案】氮 铝 氩 钙 K K F F 相同 是 ![]() HClO4 高氯酸 Al(OH)3 Al(OH)3+3HCl=== AlCl3+3H2O
HClO4 高氯酸 Al(OH)3 Al(OH)3+3HCl=== AlCl3+3H2O
【解析】
由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为Cl、⑨为Ar、⑩为K、⑾为Ca、⑿为Br,据此分析。
由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为Cl、⑨为Ar、⑩为K、⑾为Ca、⑿为Br。
(1)下列元素名称①为氮,⑤为铝,⑨为氩,⑾为钙;
(2)同周期自左而右金属性减弱、同主族自上而下金属性增强,故上述元素中K元素的金属性最强;除稀有气体元素以外,同周期自左而右原子半径减小、同主族自上而下原子半径增大,故上述元素中K的原子半径最大;F的原子半径最小;同周期自左而右非金属性增强、同主族自上而下非金属性减弱,故上述元素中F元素的非金属性最强,非金属性越强,其气态氢化物的稳定性越强,则其氢化物最稳定的是F;
(3)元素②和③形成的离子F-和Na+都为10电子离子,它们的电子层结构相同,两者形成的化合物NaF由钠离子和氟离子构成,属于离子化合物,该化合物的电子式为![]() ;
;
(4)元素⑧的最高价氧化物对应的水化物化学式为:HClO4,名称为高氯酸;
(5)在这些元素的最高价氧化物对应的水化物中,属于两性氢氧化物的是Al(OH)3,Al(OH)3和盐酸反应生成氯化铝和水,反应的化学方程式为Al(OH)3+3HCl=== AlCl3+3H2O。


科目:高中化学 来源: 题型:
【题目】高铁酸钾(![]() )是新型的绿色环保水处理剂。一种制备
)是新型的绿色环保水处理剂。一种制备![]() 的流程如下:
的流程如下:
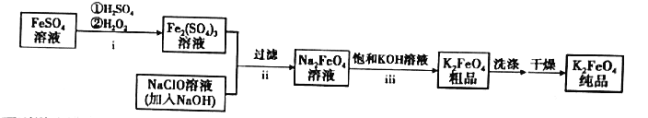
下列说法错误的是( )
A.步骤i中反应的离子方程式为![]()
B.步骤ⅱ说明碱性条件下,氧化性:![]()
C.步骤ⅲ的反应为复分解反应,说明溶解度:![]()
D.![]() 作为性能优良的水处理剂,主要是利用了其强氧化性和还原后产生的具有絮凝作用的Fe(Ⅲ)
作为性能优良的水处理剂,主要是利用了其强氧化性和还原后产生的具有絮凝作用的Fe(Ⅲ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.![]() =1012的溶液中:NH4+、Al3+、NO3-、Cl-
=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有一瓶无色澄清溶液,其中可能含H+、Na+、Mg2+、Ba2+、Cl、SO42、CO32离子。现进行以下实验:
A、用pH试纸检验溶液,发现溶液呈强酸性;
B、取部分溶液逐滴加入NaOH溶液,使溶液由酸性变为碱性,无沉淀产生;
C、取少量B中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生。
①根据上述事实确定:该溶液中肯定存在的离子有_________________________;
肯定不存在的离子有___________________________。
②写出C中发生反应的离子方程式________________________________。
(2)①还原铁粉与高温水蒸气反应的化学方程式:_____________________________;
②除去Mg粉中的Al粉的试剂是__________________,反应的离子方程式为:___________________________________;
(3)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下面离子方程式。
____Fe(OH)3 +____ClO-+____OH- =__FeO42-+___Cl-+_____ _______
(4)在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,氧化剂是___________;
当有2mol H3PO4生成,转移的电子的物质的量为__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D的位置如右图所示, B、C两元素的原子序数之和是A元素原子序数的4倍,各元素对应的物质相互比较,其中关系正确的是

A.原子半径:C>D>AB.单质的熔点:B>C,D>A
C.最高正价:B>D=A>CD.气态氢化物的稳定性:B>C,D>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有氯化钠和碘化钠的混合物共26.7 g,溶于水,通入足量氯气后,蒸干、灼烧,固体质量变为 17.55 g。
(1)原混合物中碘化钠的质量是________。
(2)原混合物中氯化钠的质量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热N2O5时,发生以下两个反应:N2O5(g)![]() N2O3(g)+O2(g),N2O3(g)
N2O3(g)+O2(g),N2O3(g)![]() N2O(g)+O2(g),在1L密闭容器加热4mol N2O5,达到平衡时,c(O2)为4.5mol·L-1,c(N2O3)为1.62mol·L-1.则c(N2O5)为
N2O(g)+O2(g),在1L密闭容器加热4mol N2O5,达到平衡时,c(O2)为4.5mol·L-1,c(N2O3)为1.62mol·L-1.则c(N2O5)为
A. 1.44mol·L-1 B. 3.48mol·L-1 C. 0.94mol·L-1 D. 1.98mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同。试回答:

(1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式:____,若要检验生成的产物,则B、C、D、E、F中应分别加入的试剂为__、__、__、__、__,E中试剂和C中相同,E中试剂所起的作用__,B装置除可检出某产物外,还可起到__作用。
(2)若进行上述实验时在F中得到10.0 g固体,则A中发生反应转移的电子数为__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下2.24LSO3溶于水生成0.1mol![]()
B.6.4g由SO2和S2组成的混合物含有的原子数大于0.2NA
C.1mol锌和足量的浓H2SO4完全反应,转移的电子数小于2NA
D.12g金刚石(C)中含有的共价键数目为4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com