
【题目】短周期元素A、B、C、D的位置如右图所示, B、C两元素的原子序数之和是A元素原子序数的4倍,各元素对应的物质相互比较,其中关系正确的是

A.原子半径:C>D>AB.单质的熔点:B>C,D>A
C.最高正价:B>D=A>CD.气态氢化物的稳定性:B>C,D>A
【答案】B
【解析】
设A的质子数设a,则根据元素的位置可知,B、D、C的质子数分别是a+7、a+8、a+9,因此有a+7+a+9=4a,解得a=8,所以A、B、C、D分别是O元素、P元素、Cl元素、S元素。
根据上述分析可知:A是O,B是P,C是Cl,D是S元素。
A. 同一周期元素,从左到右原子半径依次减小,不同周期的元素,原子核外电子层数越多,原子半径越大,则原子半径应该是D>C>A,A错误;
B. 固体单质的熔点高于气体的熔点,则单质的熔点:磷单质>氯气,硫单质>氧气,B正确;
C. 氧元素没有正化合价,C错误;
D. 元素的非金属性越强,其相应的简单的气态氢化物的稳定性就越强,元素的非金属性:Cl>P,O>S,则气态氢化物的稳定性:Cl>P,O>S,D错误;
故合理选项是B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】该小组的同学设计了如图所示的实验装置(夹持及尾气处理装置未画出),探究氨气的还原性。
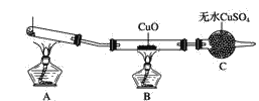
(1)利用该装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。则氨气与CuO反应的化学方程式为___。
(2)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物,在酸性溶液中,Cu+→Cu+Cu2+。请设计一个简单的实验检验该红色物质中是否含有Cu2O。____。
(3)该装置在设计上存在明显缺陷,为保证实验结果的准确性,需在A和B之间增加一个装置D,为什么?___。
请画出装置D的示意图并表明所需试剂_____、_____。(限选仪器和药品:浓H2SO4、碱石灰、集气瓶、干燥管、玻璃导管、单孔赛、双孔塞)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学学习了同周期元素性质的递变规律后,设计了一套实验方案进行实验探究,并记录了有关实验现象,如下表。

请你帮助该同学整理并完成实验报告。
(1)实验目的:__________________。
(2)实验仪器:①________;②________;③________;④试管夹;⑤镊子;⑥小刀;⑦玻璃片;⑧砂纸;⑨胶头滴管等。
(3)实验药品:钠、镁带、铝条、2 mol·L-1盐酸、新制的氯水、硫化氢饱和溶液、氯化铝溶液、氢氧化钠溶液等。
(4)请你写出上述的实验操作对应的现象(用A~F表示):
①________;②________;③________;④________;⑤________;⑥________。
(5)写出实验操作②、⑥中有关反应的离子方程式:
实验②________________________,实验⑥______________________。
(6)实验结论:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.熵增原理不可独立作为反应自发性的判据
B.生产普通玻璃的主要原料为石灰石、纯碱和石英砂
C.硫元素在自然界的存在形式有硫单质、硫化物和硫酸盐等
D.6.4gCu与3.2g硫粉混合隔绝空气加热,充分反应后,转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有氯化钠和碘化钠的混合物共26.7 g,溶于水,通入足量氯气后,蒸干、灼烧,固体质量变为 17.55 g。
(1)原混合物中碘化钠的质量是________。
(2)原混合物中氯化钠的质量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某简单(单核)粒子的原子核外有18个电子。
(1)若为原子,请画出其原子结构示意图_________。
(2)若为阳离子,请写出其常见的离子符号_______。
(3)若为阴离子,请写出其常见的离子符号_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇水蒸气重整制氢方法是目前比较成熟的制氢方法,且具有良好的应用前景。甲醇水蒸气重整制氢的部分反应过程如图所示:
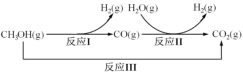
(1)已知一定条件下
反应I:CH3OH(g)=CO(g)+2H2(g) ΔH1=+90.7kJ/mol
反应III:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH3=+49.5kJ/mol
该条件下反应II的热化学方程式是___。
(2)已知反应II在进气比[n(CO):n(H2O)]不同时,在不同温度(T1、T2)下,测得相应的CO的平衡转化率见图。
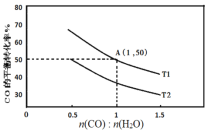
①比较T1、T2的大小,T1___T2(填“>”“<”或“=”)。
②A点对应的化学平衡常数是___。
③T1温度时,按下表数据开始反应建立平衡
CO | H2O | H2 | CO2 | |
起始浓度(mol/L) | 2 | 1 | 0 | 0 |
t时刻浓度(mol/L) | 1.2 | 0.2 | 0.8 | 0.8 |
反应进行到t时刻时,判断v(正)、v(逆)的大小关系为:v(正)___v(逆)(填“>”“<”或“=”)。
④当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是___。
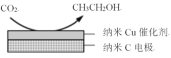
(3)CO2在生产中有着广泛的用途。
①将过量CO2通入KOH溶液中可生成KHCO3,请写出该反应的离子方程式___。
②在经CO2饱和处理的KHCO3弱酸性溶液中,电解活化CO2可以制备乙醇,原理如图所示。该电极为___(填“阴极”或“阳极”),电极反应式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯氧化法处理CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
⑴某厂废水中含KCN(N为-3价,KOCN也是),其浓度为650mg·L-1。现用氯碱法处理,发生如下反应:KCN+2KOH+Cl2=KOCN+2KCl+H2O,被氧化的元素是_______。
⑵投入过量的液氯,可以将氰酸盐进一步氧化为N2,化学方程式为2KOCN+4KOH+3Cl2=N2↑+2CO2↑+6KCl+2H2O,若处理上述废水20L,使KCN完全转化为无毒物质,计算需要液氯的质量。___________若将所需液氯换成氯气,则所需氯气在标准状况下的体积为多少?______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用胆矾制取氧化铜,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用,实验步骤如下:①称量ag胆矾固体放入烧杯中,加水制成溶液,向其中滴加氢氧化钠溶液至沉淀完全;②过滤步骤①中的混合物,洗涤固体;③将②中的固体转移至蒸发皿中,加热至固体全部变成黑色氧化铜为止,称量所得固体质量为bg;④取一定质量的上述氧化铜固体和一定质量的氯酸钾固体,混合均匀后加热,收集反应生成的氧气(装置如图所示)。请回答下列问题:
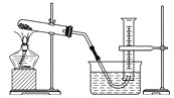
(1)上述各步操作中,需要用到玻璃棒的是________(填写前面所述实验步骤的序号)。
(2)由胆矾制得的氧化铜的产率(实际产量与理论产量的百分比)为________×100%。
(3)为证明氧化铜在氯酸钾的分解反应中起催化作用,在上述实验①~④后还应该进行的实验操作是__________(按实验先后顺序填写字母序号)。
a.过滤 b.烘干 c.溶解 d.洗涤 e.称量
(4)但有很大一部分同学认为,还必须另外再设计一个实验才能证明氧化铜在氯酸钾受热分解的实验中起催化作用。你认为还应该进行的另一个实验是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com