
【题目】某化学兴趣小组的同学学习了同周期元素性质的递变规律后,设计了一套实验方案进行实验探究,并记录了有关实验现象,如下表。

请你帮助该同学整理并完成实验报告。
(1)实验目的:__________________。
(2)实验仪器:①________;②________;③________;④试管夹;⑤镊子;⑥小刀;⑦玻璃片;⑧砂纸;⑨胶头滴管等。
(3)实验药品:钠、镁带、铝条、2 mol·L-1盐酸、新制的氯水、硫化氢饱和溶液、氯化铝溶液、氢氧化钠溶液等。
(4)请你写出上述的实验操作对应的现象(用A~F表示):
①________;②________;③________;④________;⑤________;⑥________。
(5)写出实验操作②、⑥中有关反应的离子方程式:
实验②________________________,实验⑥______________________。
(6)实验结论:__________________________。
【答案】探究同周期元素性质的递变规律 试管 烧杯 酒精灯 B F A D C E Cl2+H2S===2HCl+S↓ Al3++3OH-===Al(OH)3↓,Al(OH)3+OH-===AlO2-+2H2O 金属性:Na>Mg>Al;非金属性:Cl>S(或同周期从左到右,元素的金属性逐渐减弱,非金属性逐渐增强)
【解析】
结合元素金属性强弱和非金属性强弱判断方法,从Na、Mg、Al与水、酸反应的难易及Al(OH)3的两性分析,探究同周期元素性质递变规律;
(1)根据实验方案可知实验目的;
(2)根据仪器的用途确定实验仪器;
(4)根据生成物的颜色、状态、溶液的酸碱性选取相应的实验现象;
(5)②氯气氧化硫化氢生成硫和氯化氢;⑥向AlCl3溶液中滴加NaOH溶液,先生成Al(OH)3沉淀,再继续滴加沉淀溶解;
(6)根据实验来分析实验的结论。
(1)实验目的是:探究同周期元素的金属性和非金属性的递变规律;
(2)钠与滴有酚酞试液冷水反应的实验,常在烧杯中进行;镁带与2 mol·L-1的盐酸反应的实验,常在试管中进行;铝条与2 mol·L-1的盐酸反应的实验,常在试管中反应,向氯化铝溶液滴加氢氧化钠溶液需用胶头滴管;
(4)①用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞,其现象应是:有气体产生,产生的气体可在空气中燃烧,溶液变成浅红色(选B);
②向新制的硫化氢饱和溶液中滴加新制的氯水,氯气会将硫离子氧化为单质硫,出现黄色沉淀(选F);
③钠与滴有酚酞试液的冷水反应,反应方程式是2Na+H2O===2NaOH+H2↑,其离子方程式是2Na+H2O===2Na-+2OH-+H2↑,其现象应该是:浮于水面,熔成小球,在水面上无定向移动,随之消失,溶液变成红色(选A);
④镁带与2mol·L-1盐酸剧烈反应,产生的气体可以在空气中燃烧(选D)。值得注意的是镁比铝活泼,因此与盐酸反应,镁比铝剧烈;
⑤铝条与2mol·L-1的盐酸反应,其化学方程式是2Al+6HCl===2AlCl3+3H2↑,即离子方程式是2Al+6H+===2Al3++3H2↑,其现象是:反应不十分剧烈,产生的气体可以在空气中燃烧(选C);
⑥向氯化铝溶液中滴加氢氧化钠溶液至过量,其现象:生成氢氧化铝白色胶状沉淀,继而在氢氧化钠过量时氢氧化铝与氢氧化钠反应使沉淀消失(选E);
(5)②发生反应的离子方程式为Cl2+H2S=S↓+2H++2Cl-;⑥向AlCl3溶液滴加NaOH溶液至过量,可观察到先有白色胶状的Al(OH)3沉淀生成,后继续滴加沉淀溶解,Al(OH)3与NaOH反应生成NaAlO2和水,涉及反应的离子方程式为Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O;
(6)由实验可知金属性Na>Mg>Al,非金属性Cl>S,则实验结论为同周期元素随原子序数增大,元素金属性逐渐减弱,非金属性逐渐增强。


科目:高中化学 来源: 题型:
【题目】海洋中有丰富的资源,下图为海水利用的部分过程。下列有关说法正确的是

A. 由反应①可知:相同温度下,NaHCO3 的溶解度大于 Na2CO3
B. 反应②的离子方 程式为:Br2+SO2+2H2O=SO42-+2Br-+4H+
C. 可通过电解 MgCl2 溶液制得金属镁
D. 粗盐中含有的 Mg2+、SO4 2-等杂质离子,可通过依次加入 BaCl2溶液、NaOH 溶液、盐酸等试剂加以去除
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答下列问题:
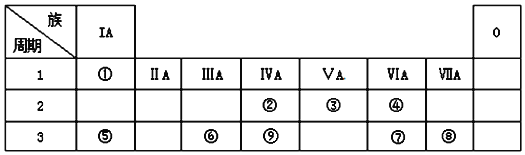
(1)第三周期中元素非金属性最强的元素的原子结构示意图为____________。
(2)②③⑨最高价氧化物对应水化物酸性强弱顺序为(填化学式)___________。
(3)用电子式表示④的简单氢化物的形成过程______________。
(4)下列可以判断⑤和⑥金属性强弱的是_________
a.⑤单质的熔点比⑥单质低
b.⑤的化合价比⑥低
c.⑤单质与水反应比单质⑥剧烈
d.⑤最高价氧化物的水化物的碱性比⑥强
(5)由表中①、③、④、⑥、⑧元素形成的常见物质Z、M、N可发生以下反应:
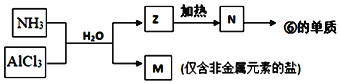
a.M中所含的化学键种类为(若含共价键,请标明极性或非极性)___________。
b.N→⑥的单质的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
A. c1∶c2=3∶1 B. 平衡时,Y和Z的生成速率之比为2∶3
C. X、Y的转化率不相等 D. c1的取值范围为0<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列8种化学符号:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。
。
(1)表示核素的符号共______种。
(2)互为同位素的是________________。
(3)质量相同的H216O和D216O所含中子数之比为________。
根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。试回答下列问题:
(4)写出Be与NaOH溶液反应生成Na2[Be(OH)4]的离子方程式:__________________
(5)Be(OH)2与Mg(OH)2可用____________________试剂鉴别。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列8种化学符号:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。
。
(1)表示核素的符号共______种。
(2)互为同位素的是________________。
(3)质量相同的H216O和D216O所含中子数之比为________。
根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。试回答下列问题:
(4)写出Be与NaOH溶液反应生成Na2BeO2的离子方程式:___________________________。
(5)Be(OH)2与Mg(OH)2可用____________________试剂鉴别。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用如图所示装置进行化学反应X+2Y![]() 2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到U形管中液面甲处降、乙处升。关于该反应的下列叙述中正确的是
2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到U形管中液面甲处降、乙处升。关于该反应的下列叙述中正确的是

①该反应为放热反应;②该反应为吸热反应;③生成物的总能量比反应物的总能量更高;④反应物的总能量比生成物的总能量更高;⑤该反应过程可以看成是“贮存“于X、Y内部的部分能量转化为热能而释放出来。
A. ①④⑤ B. ①④ C. ①③ D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D的位置如右图所示, B、C两元素的原子序数之和是A元素原子序数的4倍,各元素对应的物质相互比较,其中关系正确的是

A.原子半径:C>D>AB.单质的熔点:B>C,D>A
C.最高正价:B>D=A>CD.气态氢化物的稳定性:B>C,D>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用铝热反应焊接钢轨的原理是2Al+Fe2O3![]() 2Fe+Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褐色硬块的组成。
2Fe+Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褐色硬块的组成。
(1)将褐色硬块处理成粉末状。研究小组首先排除了含有单质Al杂质的可能性,实验方法是__,证明不含单质铝的现象是__。
(2)该褐色硬块的组成基本确定为Fe、Fe2O3,Al2O3。请以上述粉末为样品,验证其组成。限选实验仪器与试剂:烧杯、试管、玻璃棒、胶头滴管、药匙、过滤器;20%KSCN、3 mol·L-1NaOH、3mol·L-1HCl、3mol·L-1HNO3、3mol·L-1CuSO4、0.01mol·L-1KMnO4、蒸馏水。
根据你设计的实验方案,叙述实验操作、预期现象和结论。_____。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com